Encefalopatía neonatal e Hipotermia terapéutica
Enero 2022
Propuesta de un paquete de prácticas de cuidado para Encefalopatía neonatal durante Hipotermia terapéutica
Pia Wintermark
Seminars in Fetal and Neonatal Medicine
2021
1. Introducción
Hasta 2005, el cuidado del recién nacido
con encefalopatía neonatal (EN) por presunta hipoxia-isquemia era solamente de
soporte. Con la aparición de la hipotermia terapéutica (HT), el cuidado de
estos recién nacidos, a menudo en estado crítico, ha evolucionado
significativamente, centrándose en la neuroprotección y mejorando los resultados
del desarrollo neurológico a largo plazo. Ensayos controlados aleatorizados han
demostrado que la HT cuando se aplica dentro de las primeras 6 h después del
nacimiento a recién nacidos a término y casi a término con EN moderada-grave
secundaria a hipoxia-isquemia, mejoró significativamente la sobrevida y el
outcome a los 2 años de edad [1], con beneficios que se extienden hasta la
edad escolar [2]. En 2010, el Comité Internacional de Enlace sobre Reanimación
(ILCOR) recomendó que la HT se considerara como tratamiento estándar para todos
los recién nacidos que cumplieran con los criterios de los ensayos aleatorizados
[3]. Desde entonces, grupos de investigación de todo el mundo se han centrado en
evaluar las prácticas de atención que pueden aumentar el beneficio de la TH o
están asociados con daño potencial o peores resultados.
El cuidado de estos recién nacidos es complejo y requiere experiencia
multidisciplinaria para lograr el mejor resultado posible para estos pacientes y
sus familias.
La implementación de paquetes de cuidado es un enfoque de uso común en la
medicina de cuidados intensivos. El uso de guías , protocolos y paquetes de
cuidado se asocia con mejores resultados clínicos en entornos de cuidados
intensivos para adultos, pediátricos y neonatales. Los paquetes de atención son
un grupo de prácticas basadas en evidencia que, cuando se implementan juntas de
manera confiable, pueden mejorar tanto la calidad de la atención como los
outcomes de los pacientes. Cuando se siguen con alta fidelidad, los paquetes
son útiles para los médicos que manejan pacientes críticos complejos y pueden
reducir las variaciones en la práctica. En los recién nacidos prematuros, los
paquetes de atención que se enfocan en el manejo en las primeras horas y los
primeros días después del nacimiento se han utilizado de manera efectiva para
reducir la incidencia de hemorragia intraventricular [4-6]. Otros paquetes
exitosos en neonatología incluyen paquetes para reducir las infecciones de la
vía central [7], disminuir la exposición a los antibióticos [8] y aumentar el
uso de presión positiva continua en las vías respiratorias al momento del parto para
reducir la necesidad de ventilación invasiva y la morbilidad en los prematuros [9].
Un enfoque integral similar para el cuidado de los recién nacidos con EN de moderada a grave mostró un impacto en la mejora de los outcomes [10,11]. Sin embargo, no existe un paquete de neuroprotección publicado para los recién nacidos con EN tratados con HP. Posteriormente, existe mucha variación en la práctica de atención de estos neonatos entre centros y países [12,13]. Debido a la complejidad de la atención de estos pacientes [14], proponemos el siguiente paquete basado en la evidencia publicada actualmente. Reconocemos que la evidencia en numerosas áreas discutidas continúa acumulándose y puede evolucionar con el tiempo. Además, sabemos que existen áreas de manejo, en las que es posible que nunca tengamos estudios controlados aleatorios para determinar las mejores estrategias de manejo. Finalmente, reconocemos que muchos de los elementos de este paquete pueden no ser aplicables o posibles de aplicar en entornos con recursos limitados [15].
2.- Paquete de prácticas de cuidado propuesto para EN
Proponemos un enfoque secuenciado en
el tiempo y discutimos recomendaciones específicas para el manejo de la EN al
momento del nacimiento y en las primeras horas de vida, en los primeros días
después del nacimiento y más allá de la hospitalización en la unidad de cuidados
intensivos neonatales (UCIN) (Figuras
1 y 2).

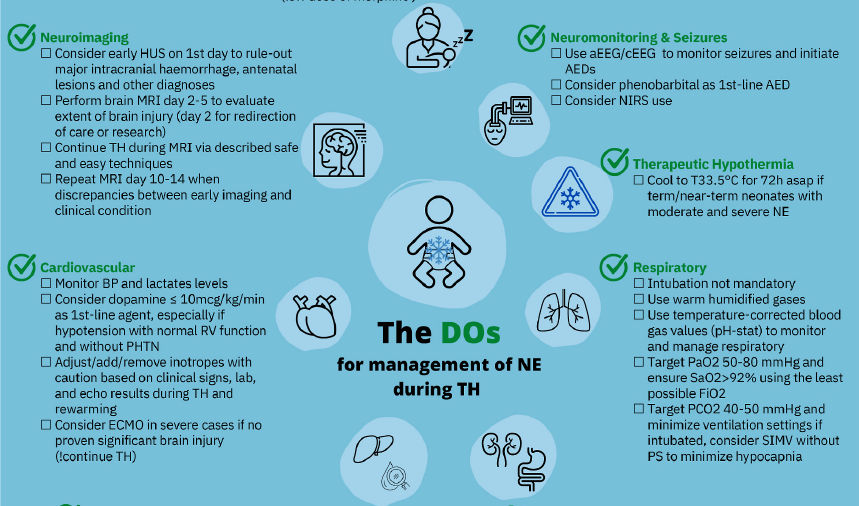

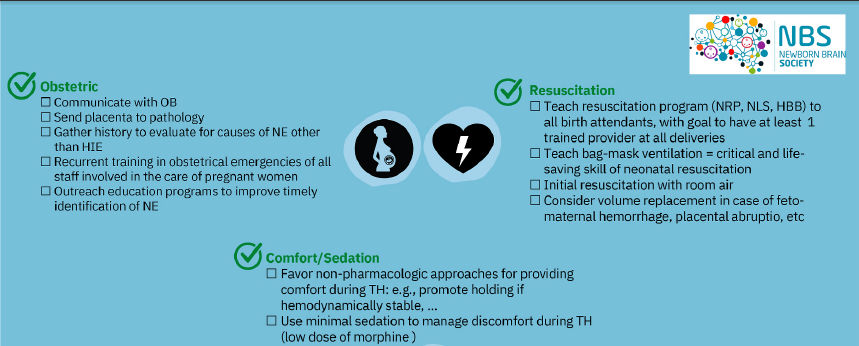
Figura 1.- DOs ("Que hacer") para manejo de neonatos con encefalopatía neonatal (EN) tratados con hipotermia terapéutica (HT). Abreviaturas: DEA : fármaco antiepiléptico; aEEG : electroencefalograma de amplitud integrada; asap : tan pronto como sea posible; AKI, lesión renal aguda; PA, presión arterial; Ca, calcio; cEEG; videoelectroencefalograma continuo; eco, ecocardiograma; ECMO, oxigenación por membrana extracorpórea; FiO2 : fracción de oxígeno inspirado; HBB : ayudando a los Bebés a Respirar; SUH, ecografía craneal; DI, enfermedad infecciosa; K, potasio; MBM : leche materna; MRI : imágenes por resonancia magnética; Na, sodio; NE, encefalopatía neonatal; NIRS : espectroscopia cercana a infrarrojo; NLS : soporte vital del recién nacido; PRN : Programa de Reanimación Neonatal; P : fosfato; PaO2 : presión parcial arterial de oxígeno; PCO2 : presión parcial de dióxido de carbono; PHTN, hipertensión pulmonar; RV, ventrículo derecho; SIMV, ventilación mandatoria intermitente sincronizada; HT : hipotermia terapéutica.
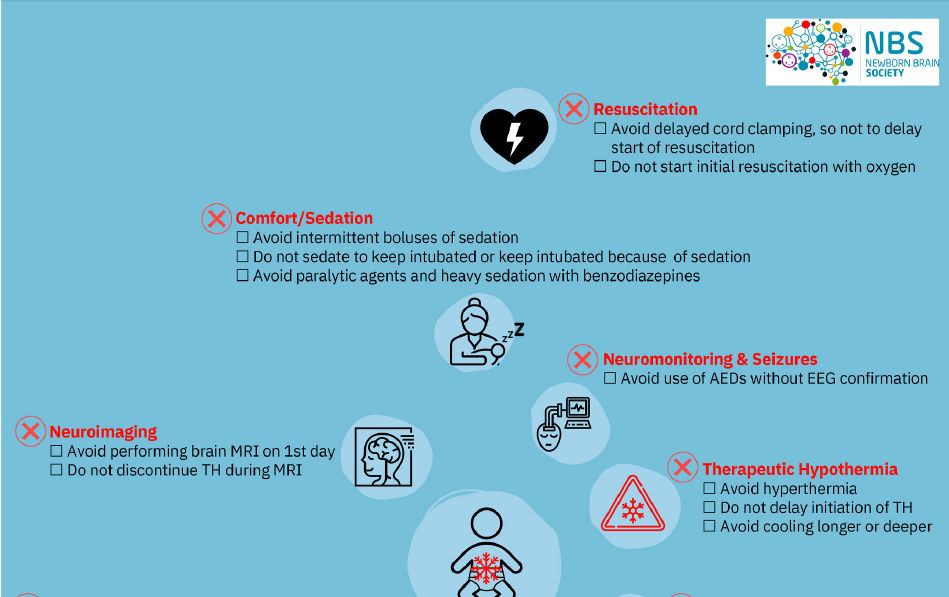


Figura 2.- Los NOs ("Que no hacer" ) en el manejo de neonatos con encefalopatía neonatal (NE)
tratados con hipotermia terapéutica (HT). Abreviaturas: AED : medicamento
antiepiléptico; EEG : electroencefalograma; NE : encefalopatía neonatal; PaO2 :
presión parcial arterial de oxígeno; PCO2 : presión parcial de dióxido de
carbono; HT : hipotermia terapéutica.
3.- Reconocimiento de EN
Los recién nacidos con EN de moderada
a grave nacen con frecuencia fuera de los centros terciarios. El diagnóstico a
menudo lo realizan médicos de primera línea que a menudo no son expertos en la
realización de examen neurológico neonatal y no están familiarizados con
los criterios de HT. Hasta a 18 % de los recién nacidos elegibles no se les
ofrece HT en el plazo correcto, debido a retraso o diagnóstico erróneo
[13]. Por otro lado, un diagnóstico erróneo puede causar mayor número de
neonatos con EN leve que reciben HT [16]. Con el fin de aplicar HT y estrategias
de cuidado neuroprotector en el tiempo correcto a todos los recién nacidos
con EN moderada y grave debido a hipoxia-isquemia perinatal presunta, los
obstetras, el personal de sala de partos, los neonatólogos y los pediatras
que brindan cuidado neonatal deben estar familiarizados con EN , HT y tener
una comprensión básica de los criterios utilizados para identificar a los recién
nacidos elegibles para el tratamiento. Por lo tanto, el primer paso es mejorar
la precisión y el tiempo de reconocimiento de EN . Los programas educativos de
extensión que utilizan simulación, módulos en línea, telemedicina y aplicaciones
de teléfonos inteligentes pueden mejorar el tiempo y la precisión del
diagnóstico de EN [10,17].
Para facilitar el reconocimiento de EN y la elegibilidad potencial para HT, se debe realizar una muestra de gasometría de cordón umbilical y/o una gasometría neonatal dentro de 1 h después del nacimiento en todos los recién nacidos a término y casi a término con antecedentes de un evento perinatal, aquellos que requieren reanimación al nacer (ej., ventilación prolongada con bolsa y máscara, intubación o masaje cardíaco) y/o que tienen un score de Apgar a los 10 minutos de 5 o menos. Si el hospital de nacimiento no tiene la capacidad de proporcionar HT , comunicación con un centro con HT debe iniciarse lo antes posible, con el objetivo de trasladar al recién nacido lo antes posible para garantizar el inicio oportuno del tratamiento. Mientras que la hipoxia-isquemia es una causa común de EN , se deben considerar otras etiologías de EN y la evaluación de estas condiciones [18,19].
3.1.- Cuidado obstétrico
Se debe obtener una historia obstétrica
detallada. El acceso al cuidado prenatal y los determinantes sociales de la
salud son los factores más importantes relacionados con la asfixia al nacer
[20]. Los factores de riesgo de asfixia en el parto relacionados con el embarazo
son comunes [21] y, por lo general, no brindan información sobre qué fetos es
probable que se vean afectados al nacer [20]. La cardiotocografía, la ecografía
y otros métodos de monitorización fetal predicen mal la asfixia al nacer [22].
Hay alguna evidencia de que la capacitación recurrente de todo el personal
involucrado en el cuidado de las mujeres (tales como interpretación de cardiotocografía estandarizada, simulacros de habilidades, ejercicios de
simulación y comunicación) mejora los resultados
[23,24].
3.2.- Evaluación de la Placenta
La patología placentaria debe realizarse
en todos los casos, ya que las patologías placentarias son un hallazgo frecuente
en el contexto de EN [25], y la patología placentaria sigue asociada con la
gravedad de la EN y el resultado adverso a pesar de la HT [26,27]. El
advenimiento de nuevas tecnologías para el análisis de la patología placentaria
lo hará más confiable y de fácil acceso en todo el mundo [28,29].
4.-
Cuidado al momento del nacimiento y en las
primeras horas
El cuidado al momento del nacimiento y
durante las primeras horas es fundamental. Esta sección se centra en la
reanimación, el inicio de HT para los recién nacidos que reúnen los
requisitos y la monitorización al lado de la cama.
4.1. Reanimación
La transición neonatal depende de la
aireación de los pulmones [30]. Los programas de reanimación neonatal se basan
en recomendaciones basadas en la evidencia del Comité Internacional de Enlace
sobre Resucitación (ILCOR) adaptados a las diferencias regionales [30]. Tres
programas de reanimación neonatal se utilizan a nivel mundial : a saber , el
Programa de Reanimación Neonatal (NRP) [31], Soporte Vital para Recién Nacidos (NLS)
[32,33] y Ayudando a los Bebés a Respirar (HBB) [34,35]. Es de suma importancia
enseñar uno de estos programas de reanimación a todos los que atienden partos [36,37] y
asegurarse de tener al menos un asistente de partos capacitado en todos los partos. La
capacidad de proporcionar ventilación con bolsa-mascarilla es clave para una
reanimación exitosa [38]. Más allá de las capacitaciones iniciales, la
optimización de la reanimación se puede lograr a través de la práctica regular
de simulación y se debe implementar una mejora continua de la calidad más allá
de las capacitaciones iniciales para optimizar la reanimación [30]. La
reanimación inicial debe realizarse con aire ambiente, ya que no hay evidencia
de beneficio de fracción de oxígeno inspirado (FiO2) 1.0, sino más bien evidencia de
daño potencial en comparación con FiO2 de 0.21 [39]. La FiO2 se puede aumentar
si, a pesar de una ventilación adecuada, la frecuencia cardíaca y la saturación
de oxígeno no mejoran [39].
4.2.- Inicio de Hipotermia terapéutica
Se debe realizar un examen neurológico (por
ejemplo, score de Sarnat modificada) dentro de la primera hora después de la
reanimación efectiva al nacer, lo que permite la recuperación y la transición
antes de determinar la elegibilidad para el tratamiento. El examen neurológico
puede evolucionar con el tiempo, por lo que pueden ser necesarios exámenes
seriados en las primeras 6 horas después del nacimiento [40,41]. Se recomienda
seguir los criterios establecidos por los Estudios randomizados controlados y evitar la práctica progresiva,
ya que aún no hay evidencia comprobada para proporcionar HT para EN leve ni para neonatos < 35 semanas de gestación al nacer [42].
Si se cumplen los criterios de elegibilidad, debe iniciarse HT lo antes
posible, con el objetivo de iniciar el tratamiento a más tardar 6 horas después
del nacimiento. La temperatura central debe controlarse estrechamente mientras se
induce TH. Los dispositivos servocontrolados son los preferidos para el manejo
preciso de la temperatura [43]. El enfriamiento pasivo se puede realizar de
manera segura con el uso de protocolos estrictos hasta que un recién nacido
pueda llegar a un centro de HT y ser colocado en un dispositivo de manejo de
temperatura servocontrolado [44]. Si no se dispone de HT , sigue siendo
importante evitar la hipertermia (> 37,5 ◦C), ya que se asocia con resultados
adversos [45].
La acidosis metabólica es un hito de la EN. El mantenimiento de la homeostasis
fisiológica en las horas / días posteriores al evento hipóxico-isquémico debería
corregir esta acidosis. La persistencia de la acidosis debe llevar a considerar
otras etiologías [46]. La reanimación con volumen debe proporcionarse según sea
necesario en forma de solución salina normal o sangre en el contexto de anemia
secundaria a hemorragia fetomaterna, desprendimiento de placenta, etc. [47].
4.3.- Monitoreo de cabecera
El advenimiento de nuevas tecnologías
ha mejorado nuestra capacidad para evaluar cómo responde el cerebro a una
enfermedad crítica [48]. El surgimiento del electroencefalograma de amplitud
integrada al lado de la cama (aEEG) y el mayor uso de electroencefalograma de
video convencional y continuo (cEEG) ha mejorado la detección, el tratamiento y
el manejo de las convulsiones, lo que mejoró los outcomes a corto plazo, tales como
la exposición a medicamentos antiepilépticos (AED). y la duración de la
estadía, pero también puede mejorar el outcome o resultado a largo plazo al reducir la
carga de convulsiones [49]. aEEG se utilizó como parte de los criterios de
entrada en dos de los estudios de HT (estudio CoolCap y estudio TOBY) [50,51]. aEEG
puede ser útil en la identificación de EN , pero no es necesario para la
selección de pacientes, y la falta de aEEG no debe retrasar el inicio de HT para
aquellos recién nacidos que cumplen con los criterios. Los avances en el uso de
la espectroscopia cercana a infrarrojo (NIRS) pueden permitirnos estudiar la
asociación de la perfusión y la oxigenación cerebrales con los outcomes
[52,53].
5. - Cuidados durante los primeros días de vida
El cuidado de los recién nacidos con EN es
complejo con interacción entre el cerebro y los diversos sistemas de órganos.
Los recién nacidos con EN a menudo presentan disfunción multiorgánica que
requiere un manejo especializado multidisciplinario. Se demostró que la gravedad
de la enfermedad durante los primeros días de vida, y no solo durante el evento
de asfixia inicial, es un predictor significativo de resultados adversos en los
recién nacidos con EN tratados con HT [54]. Esta sección se centra en el
mantenimiento de la homeostasis fisiológica. Enumeramos un enfoque basado en
sistemas para garantizar que se tengan en cuenta las múltiples facetas de la
atención que se requieren en el contexto de la EN.
5.1.- Sistema respiratorio
Si bien muchos recién nacidos con EN
tratados con HT son intubados al nacer durante la reanimación inicial, la
evidencia reciente sugiere que no es obligatorio mantenerlos intubados durante
todo el tratamiento con HT [55,56]. Solo una pequeña proporción de recién
nacidos con EN presentan síndrome de aspiración de meconio y síndrome de
dificultad respiratoria aguda subsiguiente; la mayoría no tiene enfermedad
pulmonar parenquimatosa significativa, excepto que algunos pueden tener un grado
de hipertensión pulmonar persistente. Si el paciente está estable (es decir, sin
enfermedad pulmonar parenquimatosa, sin hipertensión pulmonar persistente grave
y sin convulsiones refractarias que requieran múltiples bolos de medicamentos),
se puede considerar la extubación, ya que la ventilación mecánica puede empeorar
la hipocapnia [57,58]. Además, es importante recordar que la HT reduce la tasa
metabólica (metabolismo basal) , lo que disminuye la producción de dióxido de carbono (CO2) y el
consumo de oxígeno (O2) [59], y desplaza la curva de disociación de la
hemoglobina hacia la izquierda, lo que requiere una presión arterial parcial de
oxígeno más baja (PaO2) para lograr la misma saturación de oxígeno periférico (SpO2)
[60].
Los niveles de CO2 debe controlarse de cerca para evitar la hipocapnia [presión parcial objetivo o Target de dióxido de carbono (PCO2) debe ser 40-50 mmHg], considerando su conocida contribución a la lesión cerebral [61,62]. Si se mantiene intubado, se debe hacer todo lo posible para corregir la hipocapnia, incluso si el pH permanece bajo [58,62].
Los parámetros de ventilación deben minimizarse tanto como sea posible si está intubado, y debe considerarse la ventilación mandatoria intermitente sincronizada (SIMV) sin soporte de presión para minimizar la hipocapnia, ya que otros modos de ventilación, tales como la ventilación con soporte de presión o la ventilación A/C (asistida-controlada) , aumentarían la ventilación por minuto disminuyendo aún más el CO2,58 contribuyendo así al empeoramiento de la lesión cerebral. Asegurar que la saturación de oxígeno sea adecuada utilizando la menor FiO2 posible (PaO2 objetivo de 50 a 80 mmHg), ya que los radicales de oxígeno secundarios a la hiperoxemia (PaO2 >100 mmHg) pueden contribuir a la lesión cerebral. Si se proporciona soporte respiratorio, el gas inspirado debe calentarse a 37 ◦C y humidificarse en neonatos con EN tratados con HT ; se desaconseja disminuir a 33 ◦C debido a riesgo potencial de lesión pulmonar y broncoespasmo [63]. El método pH-stat (es decir, la corrección de los valores de gas a la temperatura real del neonato) es el método más utilizado para interpretar los valores de gases en sangre en neonatos con EN tratados con HT [64], ya que la solubilidad de los gases aumenta con la disminución de la temperatura y la interpretación a 37 ◦C puede subestimar el grado de hipocapnía. Se desaconseja el uso de tampones alcalinos (ej; bicarbonato de sodio) para corregir el pH, considerando sus posibles efectos secundarios en el cerebro [65].
5.2.- Sistema Cardiovascular
La disfunción cardíaca y la inestabilidad
hemodinámica son características comunes de los recién nacidos con EN , siendo la
hipotensión y la hipertensión pulmonar persistente las dos complicaciones
clínicas más comunes [66-69]. Los recién nacidos con EN que presentan
hipertensión pulmonar persistente también tienen más posibilidades de
desarrollar hemorragia pulmonar [68]. La HT y el recalentamiento pueden
modificar aún más la hemodinámica cardiovascular [70,71], y los agentes
inotrópicos deben ajustarse cuidadosamente. Aún no está claro cuál es el umbral
de presión arterial específico en el que se debe proporcionar tratamiento para
optimizar la hemodinámica cardiovascular [12], con el objetivo de la
neuroprotección en recién nacidos con EN que pueden tener una autorregulación
alterada [72-74]. Los inotrópicos deben usarse con cuidado, ya que su uso en el
contexto de inestabilidad hemodinámica se ha asociado con una mayor tasa de
lesión cerebral en recién nacidos con EN tratados con HT [66,75]. Además, ningún
estudio ha probado aún qué fármacos cardiovasculares optimizan la hemodinamia y
los outcomes cerebrales en esta población. La dopamina es el fármaco más
utilizado como tratamiento de primera línea para tratar la hipotensión en los
recién nacidos con EN [12,76]. Sin embargo, su uso puede no ser óptimo en caso
de insuficiencia respiratoria hipoxémica y/o hipotensión refractaria y pueden
ser necesarios agentes adicionales en estos casos [74].E [12,76].
En caso de hipertensión pulmonar aguda con o sin aspiración de meconio, se puede considerar la óxido nítrico inhalado , milrinona y/o sedación [74]. En caso de hipotensión refractaria con o sin hipertensión pulmonar aguda : se pueden considerar norepinefrina < 0,1 mcg/kg/min, hidrocortisona, dobutamina ≤ 10 mcg/kg/min y/o epinefrina < 0,1 mcg/kg/min [74]. Un aumento secundario de lactato, después de una disminución inicial, puede indicar la necesidad de reevaluar la hemodinamia y modificar el tratamiento en curso [46]. Además, ningún estudio ha determinado aún los mejores biomarcadores cardiovasculares en este contexto; mientras la investigación está en curso, la observación clínica debe complementarse con ecocardiografía para dirigir los tratamientos y debe repetirse para monitorear sus efectos y la necesidad de titular hasta el efecto deseado [74]. Si está disponible, en los casos más extremos, se debe considerar la oxigenación por membrana extracorpórea (ECMO) en EN , especialmente si no se ha identificado una lesión cerebral significativa [77,78]; en estos casos, sigue siendo importante continuar con la HT a través del circuito ECMO para preservar los beneficios de la HT en el cerebro.
5.3.- Líquidos , electrolitos, nutrición
y manejo del Sistema Renal
La EN puede asociarse con disfunción renal
y lesión renal aguda (IRA), las que contribuyen a mortalidad y morbilidad
neonatales, incluyendo outcome neurológico adverso [79–82]. Además, el
impacto de la HT sobre la lesion renal aguda (AKI) en recién nacidos con EN aún no está claro [1,83]. La
evidencia disponible sugiere comenzar con líquidos a 60-70 ml/kg/día según
corresponda para los recién nacidos en el primer día de vida [84]. El manejo de
líquidos y electrolitos debe individualizarse luego durante la HT y el
recalentamiento según las necesidades de cada recién nacido en función de una
estrecha vigilancia de diuresis, balance de líquidos, creatinina y
electrolitos para minimizar la disfunción renal [84].
Debe evitarse una mayor restricción sistémica de líquidos y sodio en esta
población, ya que se asoció con una tendencia hacia una mayor tasa de
hipoglucemia, Insuficiencia renal aguda y outcomes adversos del neurodesarrollo [83,88]. La
terapia de soporte renal puede ser necesaria en casos de sobrecarga de líquidos
significativa y/o uremia. La administración de líquidos por vía intravenosa con
una concentración adecuada de dextrosa es una parte importante de la nutrición
temprana y la salud cerebral óptima para estos recién nacidos. En este punto, no
hay evidencia adecuada para recomendar fluidos intravenosos básicos con dextrosa
y electrolitos versus nutrición parenteral; la nutrición parenteral puede
mejorar el crecimiento y la reparación del cerebro [85,86], pero también se ha
asociado con trastornos electrolíticos e infecciones [86-88]. Por lo tanto, es
probable que sea una mejor práctica personalizar los líquidos para satisfacer
las necesidades de glucosa y electrolitos de cada recién nacido individual con
EN durante la HT.
Es deseable monitorear estrechamente la
glucosa durante las primeras horas y primeros días de vida [88-92]. Lograr niveles de
glucosa fisiológicos constantes es de suma importancia en los recién nacidos con
EN durante la HT, ya que los episodios de hipoglucemia o hiperglucemia y las
grandes variaciones en la glucemia pueden empeorar el outcome del desarrollo
neurológico [88-95]. Umbrales para definir hipoglucemia [definida con mayor
frecuencia como < 2,6 mmol/L (47 mg/dL)] e hiperglucemia [definida con mayor
frecuencia como > 8,3 mmol/L (150 mg/dL)] siguen estando mal definidos y pueden variar según las condiciones comórbidas y las
adaptaciones metabólicas alteradas [96]. Los recién nacidos con EN también
corren el riesgo de desequilibrios electrolíticos. La hiponatremia es la más
frecuente y está relacionada con la pérdida urinaria de sodio relacionada con
AKI (insuficiencia renal aguda) y la disminución de la reabsorción tubular de sodio, la sobrecarga hídrica
iatrogénica y el síndrome de producción inadecuada de hormona antidiurética (SIADH)
[80].
La restricción de la ingesta de sodio se ha asociado con concentraciones séricas
de sodio más bajas y un mayor riesgo de AKI [80], por lo que no se recomienda.
Además, la hipotermia desplaza el potasio al espacio intracelular, por lo que
las personas con EN y AKI corren el riesgo de hiperpotasemia durante la fase de
recalentamiento, debido al desplazamiento del potasio al espacio extracelular.
Se justifica una monitorización cuidadosa de los valores de potasio sérico
durante la fase de recalentamiento de la terapia y hasta que se resuelva la AKI
o IRA
[1,97]. Hipocalcemia, hipercalcemia, hiperfosfatemia y acidosis también se
observan en neonatos con NE y deben ser monitoreados cuidadosamente y se debe
hacer un ajuste en los líquidos intravenosos [84].
La mayoría de los recién nacidos con EN todavía se mantienen sin ingesta por boca (per os) durante la HT debido a su enfermedad crítica y la preocupación por una posible isquemia intestinal. Sin embargo, estudios recientes han comenzado a demostrar la seguridad de la introducción incremental de nutrición enteral (idealmente con leche materna) en recién nacidos hemodinámicamente estables con EN durante HT [98] y el beneficio potencial de esta nutrición enteral mínima en los resultados a corto plazo [99,100 ]. De hecho, la falta de suministro inmediato de nutrientes después de eventos hipóxico-isquémicos puede empeorar aún más las lesiones cerebrales progresivas [99]. Queda por determinar el impacto de la homeostasis óptima de la glucosa y la nutrición en los resultados del desarrollo neurológico a largo plazo en los recién nacidos con EN tratados con HT [96].
5.4.- Manejo de problemas hematológicos
Los problemas hematológicos son comunes en
los recién nacidos con EN durante la HT e incluyen trombocitopenia,
hipofibrinogenemia y coagulopatía, activación de monocitos y neutrófilos, anemia
y aumento del recuento de glóbulos rojos nucleados [101–103]. Existe una falta
de consenso sobre los niveles óptimos para la intervención durante la HT, debido
a la falta de conocimiento de los valores óptimos durante la HT y la falta de
estudios de intervención en estos recién nacidos [102,103]. El consenso general
de las guías en todo el mundo sugiere 1) transfundir plaquetas si las plaquetas
están por debajo de 25.000/mL y sin sangramiento importante; 2) transfundir
plasma fresco congelado (PFC) en caso de sangrado clínicamente significativo o
con PT o APTT por encima de 1,5 veces el rango normal; 3) transfundir
crioprecipitado si el fibrinógeno está por debajo de 1.0–1.5 g/dL; 4)
administrar vitamina K adicional si el PT está elevado; y 5) transfundir
concentrados de glóbulos rojos si la hemoglobina está por debajo de 100-110 g/L
en la primera semana de vida [102].
5.5.- Manejo de Infección y/o Inflamación
Sigue siendo importante evaluar si hay infección, sepsis y/o meningitis y tratar según sea necesario. La infección además de EN se ha asociado con un aumento de la inflamación sistémica y de la leucocitosis y con un aumento del riesgo de resultados adversos [104,105]. También se ha observado que el recuento de glóbulos blancos es significativamente mayor durante los primeros 3 días de vida en los recién nacidos con EN tratada con TH y MRI (resonancia nuclear) anormal, en comparación con los no tratados con HT y con MRI normal [106]. La HT puede ayudar o no en este contexto dependiendo del patógeno [26,27,42,107].
5.6.- Manejo de comfort y
sedación
Primero se debe considerar un enfoque no
farmacológico para brindar comodidad a los recién nacidos con EN durante la HT
[108]. Cuando sea posible, se debe alentar a los padres a sostener a su recién
nacido durante la HT, especialmente si está clínicamente estable [109]. Otras
medidas centradas en la familia aplicadas con éxito a los recién nacidos
prematuros, como el cuidado oral con la leche materna, succión no nutritiva,
el arrope facilitado, lectura a su bebé y la participación en el cuidado
(cambio de pañales, etc.) también pueden ser útiles durante la HT [110,111 ].
Estas prácticas también pueden beneficiar a los padres que a menudo están
traumatizados y estresados [112]; puede facilitar el vínculo, mejorar las
interacciones entre padres y bebés y mejorar los outcomes como en otras
poblaciones de recién nacidos [113].
Todavía está en curso el debate sobre si la sedación durante la HT puede mitigar
o intensificar el desarrollo de una lesión hipóxico-isquémica [114-117]. Sin
embargo, se acuerdan algunos principios. Los neonatos con EN tratados con HT no
deben ser sedados para mantenerse intubados; o mantenerlos intubados por más
tiempo porque están sedados [56]. La sedación debe titularse cuidadosamente, ya
que los estudios de farmacocinética y farmacodinámica siguen siendo limitados en
los recién nacidos con EN, que pueden presentar insuficiencia multiorgánica
durante la HT [108]. Si es necesario, las infusiones continuas probablemente
sean mejores que los bolos intermitentes de sedación, ya que los bolos pueden
aumentar el riesgo de efectos adversos [108]. Las infusiones deben suspenderse
durante el recalentamiento [108]. Entre los agentes sedantes, la morfina es
probablemente el agente con la evidencia más sólida en términos de seguridad
para su uso durante la HT [118,119]. Las benzodiazepinas deben usarse solo si es
necesario debido a sus posibles efectos hemodinámicos y neurológicos adversos
[117,119, 120]
Recientemente, se ha propuesto la infusión de dexmedetomidina en dosis bajas como alternativa a la morfina para los recién nacidos con EN tratados con HT. Sin embargo, la farmacocinética y la farmacodinámica y la dosis óptima de dexmedetomidina no se conocen para esta población [121]. Además, aunque la evidencia preclínica sugiere que la dexmedetomidina puede ser beneficiosa en este contexto [122,123], esto aún debe determinarse clínicamente antes de su uso generalizado. Además, la dexmedetomidina puede causar bradicardia significativa, lo que puede volverse problemático en neonatos con EN , en quienes ya se puede observar bradicardia durante la HT [124].
5.7.- Monitoreo y manejo de Convulsiones
Las convulsiones son comunes en el
contexto de NE y su diagnóstico se basa en una correlación de EEG. El videoelectroencefalograma continuo (cEEG) es el estándar de oro y el método de
diagnóstico preferido para guiar el tratamiento de las convulsiones durante la
HT ; El electroencefalograma de amplitud integrada (aEEG) se debe utilizar cuando
no se puede obtener el vEEG [125]. La identificación precisa de las convulsiones
basada únicamente en la observación clínica es deficiente y puede dar lugar a un
tratamiento excesivo y a una administración inapropiada al paciente de
medicamentos anticonvulsivos, así como tambien a tratamiento insuficiente de los recién
nacidos con convulsiones subclínicas, algunos de los cuales pueden tener estado
epiléptico [126, 127]. Los recién nacidos con antecedentes normales en las
primeras 24 h después del nacimiento tienen un riesgo muy bajo de desarrollar
convulsiones [128].
Actualmente, el fenobarbital sigue siendo el agente de primera línea recomendado
para tratar las convulsiones neonatales relacionadas con EN [129,130]. La fosfenitoína sigue siendo un agente de segunda línea [125]. El levetiracetam se
desempeñó mal en una comparación directa con el fenobarbital para el tratamiento
de las convulsiones sintomáticas agudas y, por lo tanto, no es un agente de
primera línea preferido [131]. El tratamiento temprano y agresivo de las
convulsiones neonatales podría ser la clave para un mejor control y outcomes
de las convulsiones [132–134]. La evidencia emergente sugiere que los ASMs se
pueden suspender de manera segura después de que se resuelven las convulsiones
agudas y antes del alta hospitalaria [135-137].
5.8.- Imagenología cerebral
La neuroimagen es útil en el contexto de la EN para identificar patrones y extensión de la lesión cerebral, para guiar las decisiones de tratamiento, para ayudar a pronosticar el resultado a largo plazo y para excluir otras etiologías distintas a lesión cerebral hipóxico-isquémica [138]. Las neuroimágenes también pueden ser útiles para ayudar a identificar a los recién nacidos candidatos para terapias neuroprotectoras y neurorrestauradoras adyuvantes, pero también para proporcionar criterios de valoración alternativos a corto plazo para evaluar la recuperación, la reparación y la reorganización después de estos tratamientos [138]. Una ecografía cerebral temprana al lado de la cama puede ser valiosa durante el primer día de vida para descartar una hemorragia intracraneal importante, lesiones prenatales y otros diagnósticos [139]. Sin embargo, la resonancia magnética nuclear (RMN o MRI) es la técnica de imagen preferida para examinar el cerebro de los recién nacidos con EN .
Las secuencias deben incluir al menos imágenes ponderadas en T1 y T2, imágenes ponderadas por difusión y espectroscopia [138]. Se recomienda una resonancia magnética temprana (días 2 a 5 de vida) para el diagnóstico y pronóstico [140–145]. La RM durante la HT ya tan temprano como en el día 2 de vida puede mostrar la extensión de la lesión cerebral y, por lo tanto, puede ser útil cuando se considera la reorientación del cuidado o con fines de investigación [138,141,145]. Existen protocolos para continuar con seguridad la HT durante la MRI [146,147] y, por lo tanto, no se debe interrumpir la HT para obtener este examen. En la práctica clínica habitual, es más práctico obtener una MRI después del recalentamiento. Se recomienda repetir la MRI en los días 10 a 14 de vida cuando persisten las discrepancias entre los hallazgos tempranos de neuroimagen y el estado clínico [138].
5.9.- Apoyo a padres
involucrándolos en el cuidado
Se debe utilizar un enfoque de toma de
decisiones compartida para discutir el manejo de los recién nacidos con EN
tratados con HT con sus padres [148]. La comunicación oportuna, transparente y
consistente ayuda a los padres a comprender el cuidado de su hijo durante la HT
,
la información pronóstica importante (p. ej., "día de resonancia magnética") y
lo que los padres deben preparar antes del alta [149]. Incluir personal de
apoyo, trabajadores sociales, psicólogos de la unidad y capellanes en las
reuniones familiares puede brindar el apoyo emocional que tanto se necesita. La
derivación a grupos de apoyo de pares y programas longitudinales de salud mental
puede ayudar a las familias durante la hospitalización y después del alta [149].
Se debe alentar a los padres a estar presentes junto a la cuna y participar en
el cuidado de su recién nacido. Sostener a su bebé durante la HT se puede hacer
de manera segura, promueve el vínculo, puede reducir la incomodidad y puede ayudar
a los padres a sobrellevar el estrés de tener un hijo en la unidad de cuidados
intensivos neonatales [109]. Otras intervenciones que han demostrado ser
exitosas para los recién nacidos prematuros también pueden ser útiles para los
recién nacidos con EN y sus familias :
Empoderar a las familias a través del modelo de Atención Centrada en la Familia (FICARE) [150];
optimizar la nutrición [151];
Cuidado del desarrollo [152].
Cuidado piel a piel y terapia de masajes [153,154];
Sonidos estimulantes positivos como musicoterapia y programas de lectura [155];
Voz de los padres [156,157];
Minimizar los ruidos molestos [158];
Mejorar los ciclos fisiológicos de sueño y vigilia [159]; y
Fomentar la interacción social positiva [160]
5.10.- Cuidado de piel
Los recién nacidos con EN tratados con
HT parecen tener un mayor riesgo de desarrollar necrosis grasa subcutánea [161],
especialmente aquellos con mayor peso al nacer [162]. Cuando la macrosomía
estaba presente, otros factores de riesgo relacionados con la inestabilidad
hemodinámica durante los primeros días de vida y la restricción de líquidos
también pueden aumentar el riesgo de desarrollar necrosis grasa subcutánea
[162]. Para prevenir esta complicación, se sugiere reposicionar regularmente a
los recién nacidos durante la HT para evitar la
presión de contacto directa prolongada con la interfaz de enfriamiento [163]; sin embargo, no hay
evidencia suficiente de que el posicionamiento de los recién nacidos o la
implementación de un cuidado particular de la piel durante la HT reduzca el
riesgo de necrosis de la grasa subcutánea. Una complicación importante de la
necrosis grasa subcutánea es la hipercalcemia, y puede aparecer mucho después de
la HT y puede requerir control y posible tratamiento.
6.- Cuidado más allá de la UCIN, seguimiento de
neonatos con EN
Se ha demostrado que la HT es un tratamiento seguro y eficaz para la EN moderada y grave en recién nacidos a término / casi a término en países de altos ingresos para reducir el riesgo de muerte o discapacidad grave después de la asfixia del parto en un 15 % [1]. La eficacia de la HT en la reducción de la discapacidad del desarrollo persiste hasta los 6–8 años de edad [164,165], pero los estudios neonatales no se diseñaron ni se potenciaron para evaluar los efectos sobre el aprendizaje, la educación o el comportamiento [166]. Existe una necesidad urgente de comprender los efectos de la EN en la era de la HT en la adolescencia y la vida adulta [166]. En estudios más recientes, hasta 29 % de los recién nacidos tratados siguen desarrollando resultados adversos a pesar de la HT [167].
Una alta proporción de sobrevivientes todavía desarrollan discapacidades moderadas y graves que requieren un seguimiento estrecho en la infancia para identificar y apoyar los problemas neuromotores, cognitivos y conductuales [168]. El seguimiento del neuro desarrollo se debe realizar secuencialmente durante al menos 2 años y, si es posible, hasta la primera infancia para abordar estos desafíos [169]. Se recomienda la derivación temprana a equipos de desarrollo infantil para apoyo familiar e intervenciones tempranas. Las intervenciones tempranas de neuroplasticidad, a diferencia de las de lesión cerebral aguda, tienen como objetivo el crecimiento del cerebro mucho más allá de los primeros días de vida y después del alta de la unidad de cuidados intensivos neonatales [170]. Estas intervenciones pueden mejorar los resultados cognitivos y motores a largo plazo [153–155].
7.- Investigación en curso
Hasta el 29 % de los recién nacidos con
EN tratados con HT siguen desarrollando outcomes adversos a pesar de la HT
[42,167]. Por lo tanto, es de suma importancia descubrir terapias
neuroprotectoras y neurorrestauradoras complementarias para mejorar aún más los
resultados. Se están probando activamente diferentes agentes en todo el mundo
[171], basados en los mecanismos de lesión identificados [172]. Los estudios
de estas nuevas terapias deben diseñarse cuidadosamente con definiciones claras
para el ingreso al estudio y outcomes claros para dilucidar las mejores
opciones de tratamiento para los recién nacidos con EN [125]. Quedan por
determinarse y acordarse las mejores medidas de outcome para estos estudios.
Después de outcomes mejorados con HT, se necesita un mayor tamaño muestral
para futuros estudios de agentes terapéuticos complementarios después de
outcomes mejorados con HT si el outcome del neurodesarrollo sigue siendo la
medida de outcome [166]. Los biomarcadores medidos en el período
inmediatamente posterior al tratamiento se han propuesto como medidas de
outcome más eficientes que los outcomes del neuroesarrollo a los
18-24 meses [173].
Además, debido al éxito de la HT entre los recién nacidos con EN moderada y
grave y al reconocimiento de que los outcomes de los recién nacidos con EN
leve pueden no ser tan buenos como se pensaba, muchos centros se han desviado de
los criterios utilizados en los RCTs y ahora ofrecen HT a recién nacidos con EN
leve [16,174]. Sin embargo, la seguridad y la eficacia aún no se han probado
[175] y se están probando activamente a través de estudios en curso [42].
Tabla 1 resume la investigación en curso y las direcciones futuras por sistema de
órganos.
Tabla 1.- Líneas de investigación para neonatos con EN tratados con HT. Esta tabla consiste en una lista no exhaustiva de investigaciones en curso en el contexto de EN y HT, destacando la evolución del cuidado esperado en los próximos años.
8.- Implementación del paquete de práctica de cuidado para EN
Determinar si este paquete de cuidado
reducirá la incidencia/extensión de la lesión cerebral en recién nacidos con EN
tratados con HT y mejorará su resultado requeriría colaboración para establecer
una cohorte internacional y mundial de recién nacidos con EN. Sería ideal
aprovechar las variaciones en las prácticas del sitio para identificar las
mejores prácticas de manejo para los recién nacidos con EN durante la HT, de
manera similar a lo que se ha hecho a nivel nacional e internacional para
mejorar la atención de los recién nacidos prematuros [176] y reducir su tasa de
hemorragia intraventricular. hemorragia e infecciones [4-6].
El primer paso sería realizar una encuesta
internacional para capturar de manera sistemática las diferencias en el manejo
en todo el mundo. Sería ideal encontrar soluciones que sean aplicables en todo
el mundo o que se puedan personalizar a la realidad de cada sitio para optimizar
las recomendaciones del paquete. Teniendo en cuenta la gran cantidad de
investigación en el área de EN , la evidencia de un paquete de prácticas de
cuidado para EN puede cambiar con el tiempo. El advenimiento de otras terapias neuroprotectoras y neurorreparadoras puede modificar aún más el resultado de
estos recién nacidos, y será necesario reevaluar constantemente la optimización
de la atención en este contexto en rápida evolución. Sin embargo, existe una
necesidad urgente de optimizar y estandarizar el cuidado ahora para los estudios
que avanzan para descartar el impacto de las prácticas de cuidado en el
outcome y garantizar que solo se pruebe el impacto de estos nuevos
tratamientos en el outcome .
9.- Conclusión
El conjunto de prácticas de cuidado
propuesto se armó seleccionando la mejor evidencia actual para cada sistema de
órganos. Queda por demostrar si el uso del paquete propuesto mejorará el
resultado de los recién nacidos con EN. Los recién nacidos con EN merecen un
cuidado cerebral optimizada para mejorar su outcome y reducir el riesgo de
discapacidades de por vida. Optimizar el manejo de cada sistema de órganos puede
aumentar la eficacia de la HT y las futuras terapias neuroprotectoras y
neurorrestauradoras adjuntas en estudio y, en última instancia, mejorar los
outcomes de estos recién nacidos.
Puntos prácticos
Los recién nacidos con EN a menudo presentan disfunción multiorgánica que requiere un manejo especializado multidisciplinario.
El cuidado de los recién nacidos con EN es, por lo tanto, complejo con interacción entre el cerebro y los diversos sistemas de órganos.
La gravedad de la enfermedad durante los primeros días de vida, y no solo durante el evento inicial de asfixia, es un predictor significativo de outcome adversos en los recién nacidos con EN tratados con HT.
Un paquete de prácticas de cuidado dedicado a apoyar el cerebro neonatal lesionado puede llevar a armonizar el cuidado de los recién nacidos con EN tratados con HT y disminuir las variaciones en el cuidado observado en todo el mundo.
Optimizar el manejo de cada sistema de órganos puede aumentar la eficacia de la HT y las futuras terapias neuroprotectoras y neurorrestauradoras adjuntas en estudio y, en última instancia, mejorar los outcomes de estos recién nacidos.
Direcciones de Investigación
Hasta el 29 % de los recién nacidos con EN tratados con HT siguen desarrollando resultados adversos a pesar de la HT. Por lo tanto, es de suma importancia descubrir terapias neuroprotectoras y neurorrestauradoras complementarias para mejorar aún más los resultados.
Existe una necesidad urgente de optimizar y estandarizar el cuidado de los recién nacidos con EN para los estudios que avanzan hacia descartar el impacto de las prácticas de cuidado sobre el outcome y garantizar que solo se pruebe el impacto de estos nuevos tratamientos en el outcome.
Determinar si este paquete de cuidado reducirá la incidencia/extensión de la lesión cerebral en recién nacidos con EN tratados con HT y mejorará su outcome requeriría colaboración para establecer una cohorte internacional y mundial de recién nacidos con EN. Sería ideal aprovechar las variaciones en las prácticas del sitio para identificar las mejores prácticas de manejo para los recién nacidos con EN durante la HT.
Sería ideal encontrar soluciones que sean aplicables en todo el mundo o que se puedan personalizar a la realidad de cada sitio para optimizar las recomendaciones del paquete de cuidado.
Teniendo en cuenta la gran cantidad de investigación en el área de EN , la evidencia de un paquete de prácticas de cuidado para EN puede cambiar con el tiempo.
El advenimiento de otras terapias neuroprotectoras y neurorreparadoras puede modificar aún más el resultado de estos recién nacidos, y la optimización del cuidado atención deberá reevaluarse constantemente en este contexto en rápida evolución.
Referencias
Jacobs SE, Berg M, Hunt R, Tarnow-Mordi WO, Inder TE, Davis PG. Cooling for newborns with hypoxic ischaemic encephalopathy. Cochrane Database Syst Rev 2013;2013(1):CD003311.
Pappas A, Shankaran S, McDonald SA, Vohr BR, Hintz SR, Ehrenkranz RA, Tyson JE, Yolton K, Das A, Bara R, Hammond J, Higgins RD. Hypothermia extended follow-up subcommittee of the Eunice kennedy shriver NICHD neonatal research network. Cognitive outcomes after neonatal encephalopathy. Pediatrics 2015;135(3):e624–34.
Perlman JM, Wyllie J, Kattwinkel J,
Atkins DL, Chameides L, Goldsmith JP, Guinsburg R, Hazinski MF, Morley C,
Richmond S, Simon WM, Singhal N,
Szyld E, Tamura M, Velaphi S. Neonatal resuscitation chapter collaborators.
Part 11: neonatal resuscitation: 2010 international consensus on
cardiopulmonary resuscitation and emergency cardiovascular care science with
treatment recommendations. Circulation 2010;122(16 Suppl 2):S516–38.
de Bijl-Marcus K, Brouwer AJ, De Vries
LS, Groenendaal F, Wezel-Meijler GV. Neonatal care bundles are associated
with a reduction in the incidence of
intraventricular haemorrhage in preterm infants: a multicentre cohort study.
Arch Dis Child Fetal Neonatal Ed 2020;105(4):419–24.
Chiriboga N, Cortez J, Pena-Ariet A, Makker K, Smotherman C, Gautam S, Trikardos AB, Knight H, Yeoman M, Burnett E, Beier A, Cohen I, Hudak ML. Successful implementation of an intracranial hemorrhage (ICH) bundle in reducing severe ICH: a quality improvement project. J Perinatol 2019;39(1): 143–51.
Murthy P, Zein H, Thomas S, Scott JN, Abou Mehrem A, Esser MJ, Lodha A, Metcalfe C, Kowal D, Irvine L, Scotland J, Leijser L, Mohammad K. Neuroprotection care bundle implementation to decrease acute brain injury in preterm infants. Pediatr Neurol 2020;110:42–8.
Bierlaire S, Danhaive O, Carkeek K,
Piersigilli F. How to minimize central lineassociated bloodstream infections
in a neonatal intensive care unit: a quality
improvement intervention based on a retrospective analysis and the adoption
of an evidence-based bundle. Eur J Pediatr 2021;180(2):449–60.
Frymoyer A, Joshi NS, Allan JM, Cohen RS, Aby JL, Kim JL, Benitz WE, Gupta A. Sustainability of a clinical examination-based approach for ascertainment of early-onset sepsis in late preterm and term neonates. J Pediatr 2020;225:263–8.
Govindaswami B, Nudelman M, Narasimhan
SR, Huang A, Misra S, Urquidez G, Kifle A, Stemmle M, Angell C, Patel R,
Anderson C, Song D, DeSandre G, Byrne J, Jegatheesan P. Eliminating risk of
intubation in very preterm infants with noninvasive cardiorespiratory
support in the delivery room and neonatal
intensive care unit. BioMed Res Int 2019;2019:5984305.
Mohammad K, Dharel D, Mehrem AA, Esser
MJ, Paul R, Zein H, Scott JN, Fiedrich E, Murthy P, Dossani S, Kopores K,
Kowal D, Montpetit J, Al Awad E,
Thomas S. Impact of outreach education program on outcomes of neonates with
hypoxic ischemic encephalopathy. Paediatr Child Health 2021;26(5):e215– 221.
Roychoudhury S, Esser MJ, Buchhalter
J, Bello-Espinosa L, Zein H, Howlett A, Thomas S, Murthy P, Appendino JP,
Scott JN, Metcalfe C, Lind J, Oliver N,
Kozlik S, Mohammad K. Implementation of neonatal neurocritical care program
improved short-term outcomes in neonates with moderate-to-severe hypoxic
ischemic encephalopathy. Pediatr Neurol 2019;101:64–70.
Giesinger RE, Levy PT, Lauren Ruoss J,
El Dib M, Mohammad K, Wintermark P, Patrick J McNamara. Cardiovascular
management following hypoxic-ischemic
encephalopathy in North America: need for physiologic consideration. Pediatr
Res 2020;18:1–8.
Xu EH, Claveau M, Yoon EW, Barrington
KJ, Mohammad K, Shah PS, Wintermark P, Canadian Neonatal Network. Neonates
with hypoxic-ischemic
encephalopathy treated with hypothermia: observations in a large Canadian
population and determinants of death and/or brain injury. J Neonatal Perinat
Med 2020;13(4):449–58.
O’Dea M, Sweetman D, Bonifacio SL, El-Dib
M, Austin T, Molloy EJ. Management of multi organ dysfunction in neonatal
encephalopathy. Front Pediatr 2020;8:
239.
Krishnan V, Kumar V, Variane GFT,
Carlo WA, Bhutta ZA, Sizonenko S, Hansen A, Shankaran S, Thayyil S, On
behalf of the Newborn Brain Society Guidelines and Publications Committee.
Need for more evidence in the prevention and management of perinatal
asphyxia and neonatal encephalopathy in low and
middle-income countries: a call for action. Semin Fetal Neonatal Med 2021:
101271 [Epub ahead of print].
Goswami IR, Whyte H, Wintermark P, Mohammad K, Shivananda S, Louis D, Yoon EW, Shah PS. Canadian Neonatal Network Investigators. Characteristics and short-term outcomes of neonates with mild hypoxic-ischemic encephalopathy treated with hypothermia. J Perinatol 2020;40(2):275–83.
Craig AK, McAllister LM, Evans S,
Melendi ME. Telemedicine consults to assess neonatal encephalopathy are
feasible in the neonatal intensive care unit.
J Perinatol 2021;41(6):1519–21.
McIntyre S, Nelson KB, Mulkey SB,
Lechpammer M, Molloy E, Badawi N, On behalf of the newborn brain society
guidelines and publications committee.
Neonatal encephalopathy: focus on epidemiology and underexplored aspects of
etiology. Semin Fetal Neonatal Med 2021:101265 [Epub ahead of print].
Sandoval Karamian AG, Mercimek-Andrews
S, Mohammad K, Molloy EJ, Chang T, Chau V, Murray DM, Wusthoff CJ, On behalf
of the newborn brain
society guidelines and publications committee. Neonatal encephalopathy:
etiologies other than hypoxic-ischemic encephalopathy. Semin Fetal Neonatal
Med 2021:101272 [Epub ahead of print].
Hill MG, Reed KL, Brown RN, on behalf of the Newborn Brain Society Guidelines and Publications Committee. Perinatal asphyxia from the obstetric standpoint. Semin Fetal Neonatal Med 2021:101259 [Epub ahead of print].
Xu EH, Mandel V, Huet C, Rampakakis E, Brown RN, Wintermark P. Maternal risk factors for adverse outcome in asphyxiated newborns treated with hypothermia: parity and labor duration matter. J Matern Fetal Neonatal Med 2019:1–9.
Alfirevic Z, Devane D, Gyte GM, Cuthbert A. Continuous cardiotocography (CTG) as a form of electronic fetal monitoring (EFM) for fetal assessment during labour. Cochrane Database Syst Rev 2017;2(2):CD006066.
Blake J, Eade M, Ruiter J, Ludwick H,
Lalonde A, Carson G. ALARM and moreOB: shaping the present and future of
labour and delivery training in Canada and
abroad. J Obstet Gynaecol Can 2019;41(Suppl 2):S201–3.
Draycott T, Sibanda T, Owen L, Akande V, Winter C, Reading S, Whitelaw A. Does training in obstetric emergencies improve neonatal outcome? BJOG 2006;113(2): 177–82.
Penn AA, Wintermark P, Chalak LF, Armstrong J, Redline R, Scher MS, Nelson KB, On behalf of the Newborn brain society guidelines and publications committee. Placental contribution to neonatal encephalopathy. Semin Fetal Neonatal Med 2021:101276 [Epub ahead of print].
Mir IN, Johnson-Welch SF, Nelson DB,
Brown LS, Rosenfeld CR, Chalak LF. Placental pathology is associated with
severity of neonatal encephalopathy and
adverse developmental outcomes following hypothermia. Am J Obstet Gynecol
2015;213(6). 849.e1-7.
Wintermark P, Boyd T, Gregas MC, Labrecque M, Hansen A. Placental pathology in asphyxiated newborns meeting the criteria for therapeutic hypothermia. Am J Obstet Gynecol 2010;203(6). 579.e1-9.
Chen Y, Zhang Z, Wu C, Davaasuren D, Goldstein JA, Gernand AD, Wang JZ. AIPLAX: AI-based placental assessment and examination using photos. Comput Med Imag Graph 2020;84:101744.
Salsabili S, Mukherjee A, Ukwatta E,
Chan ADC, Bainbridge S, Grynspan D. Automated segmentation of villi in
histopathology images of placenta. Comput
Biol Med 2019;113:103420.
Patterson J, North K, Dempsey E,
Ishoso D, Trevisanuto D, Lee AC, et al., On behalf of the Newborn Brain
Society Guidelines and Publications Committee.
Optimizing initial neonatal resuscitation to reduce neonatal encephalopathy
around the world. Semin Fetal Neonatal Med 2021:101262 [Epub ahead of print].
American academy of pediatrics. Available at: https://www.aap.org/en-us/continuing-medical-education/life-support/NRP/Pages/International-Overview.aspx.
European Resuscitation Council. Newborn Life Support program. Available at:https://www.erc.edu/courses/newborn-life-support.
Wyckoff MH, Wyllie J, Aziz K, de Almeida MF, Fabres J, Fawke J, Guinsburg R, Hosono S, Isayama T, Kapadia VS, Kim HS, Liley HG, McKinlay CJD, Mildenhall L, Perlman JM, Rabi Y, Roehr CC, Schm¨olzer GM, Szyld E, Trevisanuto D, Velaphi S, Weiner GM. Neonatal life support collaborators. Neonatal life support: 2020 international consensus on cardiopulmonary resuscitation and emergency cardiovascular care science with treatment recommendations. Circulation 2020; 142(16_suppl_1):S185–221.
Pediatrics AAo. Helping Babies Breathe
Program. Available at: https://www.aap.org/en-us/advocacy-and-policy/aap-health-initiatives/helping-babies-survive/
Pages/Helping-Babies-Breathe.aspx.
Singhal N, McMillan DD, Savich R,
Matovelo D, Santorino D, Kamath-Rayne BD. Development and impact of helping
babies Breathe educational methodology.
Pediatrics 2020;146(Suppl 2):S123–33.
Dol J, Campbell-Yeo M, Murphy GT,
Aston M, McMillan D, Richardson B. The impact of the Helping Babies Survive
program on neonatal outcomes and health
provider skills: a systematic review. JBI Database System Rev Implement Rep
2018;16(3):701–37.
Reisman J, Arlington L, Jensen L, Louis H, Suarez-Rebling D, Nelson BD. Newborn resuscitation training in resource-limited settings: a systematic literature review. Pediatrics 2016;138(2):e20154490.
Lee AC, Cousens S, Wall SN, Niermeyer
S, Darmstadt GL, Carlo WA, Keenan WJ, Bhutta ZA, Gill C, Lawn JE. Neonatal
resuscitation and immediate newborn
assessment and stimulation for the prevention of neonatal deaths: a
systematic review, meta-analysis and Delphi estimation of mortality effect.
BMC Publ Health 2011;11. Suppl 3(Suppl 3):S12.
Welsford M, Nishiyama C, Shortt C, Isayama T, Dawson JA, Weiner G, Roehr CC, Wyckoff MH, Rabi Y. International Liaison committee on resuscitation neonatal life support task force. Room Air for initiating term newborn resuscitation: a systematic review with meta-analysis. Pediatrics 2019;143(1):e20181825.
Murray DM, Bala P, O’Connor CM, Ryan
CA, Connolly S, Boylan GB. The predictive value of early neurological
examination in neonatal hypoxic-ischaemic
encephalopathy and neurodevelopmental outcome at 24 months. Dev Med Child
Neurol 2010;52(2):e55–9.
Sarnat HB, Sarnat MS. Neonatal encephalopathy following fetal distress. A clinical and electroencephalographic study. Arch Neurol 1976;33(10):696–705.
Sabir H, Bonifacio SL, Gunn AJ,
Thoresen M, Chalak LF, On behalf of the Newborn Brain Society Guidelines and
Publications Committee. Unanswered
questions regarding therapeutic hypothermia for neonates with neonatal
encephalopathy. Semin Fetal Neonatal Med 2021:101257 [Epub ahead of print].
Akula VP, Joe P, Thusu K, Davis AS, Tamaresis JS, Kim S, Shimotake TK, Butler S, Honold J, Kuzniewicz M, DeSandre G, Bennett M, Gould J, Wallenstein MB, Van Meurs K. A randomized clinical trial of therapeutic hypothermia mode during transport for neonatal encephalopathy. J Pediatr 2015;166(4). 856-861.e1-861.
O’Reilly D, Labrecque M, O’Melia M, Bacic J, Hansen A, Soul JS. Passive cooling during transport of asphyxiated term newborns. J Perinatol 2013;33(6):435–40.
Laptook A, Tyson J, Shankaran S,
McDonald S, Ehrenkranz R, Fanaroff A, Donovan E, Goldberg R, O’Shea TM,
Higgins RD, Poole WK, National Institute of
Child Health and Human Development Neonatal Research Network. Elevated
temperature after hypoxic-ischemic encephalopathy: risk factor for adverse
outcomes. Pediatrics 2008;122(3):491–9.
Al Balushi A, Guibault MP, Wintermark
P. Secondary increase of lactate levels in asphyxiated newborns during
hypothermia treatment: a reflect of suboptimal
hemodynamics (A case series). AJP Rep 2016;6(1):e48–58.
Christensen RD, Lambert DK, Baer VL,
Richards DS, Bennett ST, Ilstrup SJ, Henry E. Severe neonatal anemia from
fetomaternal hemorrhage: report from a
multihospital health-care system. J Perinatol 2013;33(6):429–34.
Chalak L, Hellstrom-Westas L, Bonifacio S, Tsuchida T, Chock V, El-Dib M, et al., on behalf of the Newborn Brain Society Guidelines and Publications Committee. Bedside and laboratory neuromonitoring in neonatal encephalopathy. Semin Fetal Neonatal Med 2021:101273 [Epub ahead of print].
Bashir RA, Espinoza L, Vayalthrikkovil S, Buchhalter J, Irvine L, Bello-Espinosa L, Mohammad K. Implementation of a neurocritical care program: improved seizure detection and decreased antiseizure medication at discharge in neonates with hypoxic-ischemic encephalopathy. Pediatr Neurol 2016;64:38–43.
Azzopardi DV, Strohm B, Edwards AD, Dyet L, Halliday HL, Juszczak E,Kapellou O, Levene M, Marlow N, Porter E, Thoresen M, Whitelaw A, Brocklehurst P, TOBY Study Group. Moderate hypothermia to treat perinatal asphyxial encephalopathy. N Engl J Med 2009;361(14):1349–58. Erratum in: N Engl J Med. 2010;362(11):1056.
Gluckman PD, Wyatt JS, Azzopardi D, Ballard R, Edwards AD, Ferriero DM, Polin RA, Robertson CM, Thoresen M, Whitelaw A, Gunn AJ. Selective head cooling with mild systemic hypothermia after neonatal encephalopathy: multicentre randomised trial. Lancet 2005;365(9460):663–70.
Peng S, Boudes E, Tan X, Saint-Martin
C, Shevell M, Wintermark P. Does nearinfrared spectroscopy identify
asphyxiated newborns at risk of developing brain
injury during hypothermia treatment? Am J Perinatol 2015;32(6):555–64.
Wintermark P, Hansen A, Warfield SK,
Dukhovny D, Soul JS. Near-infrared spectroscopy versus magnetic resonance
imaging to study brain perfusion in
newborns with hypoxic-ischemic encephalopathy treated with hypothermia.
Neuroimage 2014;85 Pt 1(1):287–93.
Wang H, Beltempo M, Rampakakis E,
Sanon PN, Barbosa Vargas S, Maluorni J, Saint-Martin C, Wintermark P.
Illness severity predicts death and brain injury in
asphyxiated newborns treated with hypothermia. Am J Perinatol 2018;35(10):
951–8.
Al Balushi A, Lopez Laporte M,
Wintermark P. The impact of ventilation on the development of brain injury
in asphyxiated newborns treated with hypothermia.
In: Hany A, Hesham AH, editors. “Respiratory management of newborns” [Invited
Chapter]. IntechOpen; August 31, 2016. https://doi.org/10.5772/63385. ISBN
978-953-51-2575-4, Print ISBN 978-953-51-2574-7, Published.
El-Dib M, Szakmar E, Chakkarapani E,
Aly H, On behalf of the Newborn Brain Society Guidelines and Publications
Committee. Challenges in respiratory
management during therapeutic hypothermia for neonatal encephalopathy.
Semin Fetal Neonatal Med 2021 [Epub ahead of print].
Giannakis S, Ruhfus M, Markus M, Stein
A, Hoehn T, Felderhoff-Mueser U, Sabir H. Mechanical ventilation, partial
pressure of carbon dioxide, increased
fraction of inspired oxygen and the increased risk for adverse short-term
outcomes in cooled asphyxiated newborns. Children 2021;8(6):430.
Lopez Laporte MA, Wang H, Sanon PN,
Barbosa Vargas S, Maluorni J, Rampakakis E, Wintermark P. Association
between hypocapnia and ventilation
during the first days of life and brain injury in asphyxiated newborns
treated with hypothermia. J Matern Fetal Neonatal Med 2019;32(8):1312–20.
Szakmar E, Kovacs K, Meder U, Bokodi
G, Szell A, Somogyvari Z, Szabo AJ, Szabo M, Jermendy A. Asphyxiated
neonates who received active therapeutic
hypothermia during transport had higher rates of hypocapnia than controls.
Acta Paediatr 2018;107(11):1902–8.
Afzal B, Chandrasekharan P, Tancredi
DJ, Russell J, Steinhorn RH, Lakshminrusimha S. Monitoring gas exchange
during hypothermia for hypoxicischemic
encephalopathy. Pediatr Crit Care Med 2019;20(2):166–71.
Greisen G. Autoregulation of cerebral blood flow in newborn babies. Early Hum Dev 2005;81:423–8.
Lingappan K, Kaiser JR, Srinivasan C,
Gunn AJ. Relationship between PCO2 and unfavorable outcome in infants with
moderate-to-severe hypoxic ischemic
encephalopathy. Pediatr Res 2016;80(2):204–8.
Greenspan JS, Wolfson MR, Shaffer TH. Airway responsiveness to low inspired gas temperature in preterm neonates. J Pediatr 1991;118:443–5.
Groenendaal F, De Vooght KM, van Bel F. Blood gas values during hypothermia in asphyxiated term neonates. Pediatrics 2009;123(1):170–2.
Escobedo MB, Aziz K, Kapadia VS, Lee
HC, Niermeyer S, Schm¨olzer GM, Szyld E, Weiner GM, Wyckoff MH, Yamada NK,
Zaichkin JG. 2019 American heart
association focused update on neonatal resuscitation: an update to the
American heart association guidelines for cardiopulmonary resuscitation and
emergency cardiovascular care. Pediatrics 2020;145(1):e20191362.
Al Balushi A, Barbosa Vargas S,
Maluorni J, Sanon PN, Rampakakis E, Saint-Martin C, Wintermark P.
Hypotension and brain injury in asphyxiated newborns
treated with hypothermia. Am J Perinatol 2018;35(1):31–8.
Giesinger RE, Bailey LJ, Deshpande P,
McNamara PJ. Hypoxic-ischemic encephalopathy and therapeutic hypothermia:
the hemodynamic perspective.
J Pediatr 2017;180:22–30.e2.
Lakshminrusimha S, Shankaran S,
Laptook A, McDonald S, Keszler M, Van Meurs K, Guillet R, Chawla S, Sood BG,
Bonifacio S, Das A, Higgins RD.
Pulmonary hypertension associated with hypoxic-ischemic
encephalopathyantecedent characteristics and comorbidities. J Pediatr
2018;196:45–51.e3.
Lapointe A, Barrington KJ. Pulmonary hypertension and the asphyxiated newborn. J Pediatr 2011;158(2 Suppl):e19–24.
Sehgal A, Linduska N, Huynh C. Cardiac adaptation in asphyxiated infants treated with therapeutic hypothermia. J Neonatal Perinat Med 2019;12:117–25.
Thoresen M, Whitelaw A. Cardiovascular
changes during mild therapeutic hypothermia and rewarming in infants with
hypoxic-ischemic encephalopathy.
Pediatrics 2000;106:92–9.
More KS, Sakhuja P, Giesinger RE, Ting
JY, Keyzers M, Sheth JN, Lapointe A, Jain A, Moore AM, Miller SP, McNamara
PJ. Cardiovascular associations with
abnormal brain magnetic resonance imaging in neonates with hypoxic ischemic
encephalopathy undergoing therapeutic hypothermia and rewarming. Am J
Perinatol 2018;35(10):979–89.
Pryds O, Greisen G, Lou H, Friis-Hansen B. Vasoparalysis associated with brain damage in asphyxiated term infants. J Pediatr 1990 Jul;117(1 Pt 1):119–25.
Rios DR, Lapointe A, Schmolzer GM,
Mohammad K, VanMeurs KP, Keller RL, et al., on behalf of the Newborn Brain
Society Guidelines and Publications
Committee. Hemodynamic optimization for neonates with neonatal
encephalopathy: physiological and therapeutic considerations. Semin Fetal
Neonatal Med 2021 [Epub ahead of print].
Mohammad K, Hicks M, Buchhalter J,
Esser MJ, Irvine L, Thomas S, Scott J, Javadyan J, Kamaluddeen M.
Hemodynamic instability associated with increased
risk of death or brain injury in neonates with hypoxic ischemic
encephalopathy. J Neonatal Perinat Med 2017;10(4):363–70.
Kovacs K, Szakmar E, Meder U, Szakacs
L, Cseko A, Vatai B, Szabo AJ, McNamara PJ, Szabo M, Jermendy A. A
randomized controlled study of low-dose
hydrocortisone versus placebo in dopamine-treated hypotensive neonates
undergoing hypothermia treatment for hypoxic-ischemic encephalopathy.
J Pediatr 2019;211:13–9. e3.
Al Balushi A, Zavalkoff S, Wintermark
P. Extracorporeal membrane oxygenation use in asphyxiated newborns treated
with hypothermia: review of the current
evidence [Invited Chapter]. In: Firstenberg MS, editor. Advances in
extracorporeal perfusion therapies. IntechOpen; January 10, 2019. https://doi.org/10.5772/intechopen.72562.
ISBN 978-1-78984-914-1, Print ISBN 978-1-78984-913-4, eBook (PDF) ISBN
978-1-83881-704-6.
Cuevas Guaman M, Lucke AM, Hagan JL,
Kaiser JR. Bleeding complications and mortality in neonates receiving
therapeutic hypothermia and extracorporeal
membrane oxygen. Am J Perinatol 2018;35:271–6.
Cavallin F, Rubin G, Vidal E, Cainelli
E, Bonadies L, Suppiej A, Trevisanuto D. Prognostic role of acute kidney
injury on long-term outcome in infants with
hypoxic-ischemic encephalopathy. Pediatr Nephrol 2020;35(3):477–83.
La Haye-Caty N, Barbosa Vargas S,
Maluorni J, Rampakakis E, Zappitelli M, Wintermark P. Impact of restricting
fluid and sodium intake in term asphyxiated
newborns treated with hypothermia. J Matern Fetal Neonatal Med 2020;33(20):
3521–8.
Sarkar S, Askenazi DJ, Jordan BK, Bhagat I, Bapuraj JR, Dechert RE, Selewski DT. Relationship between acute kidney injury and brain MRI findings in asphyxiated newborns after therapeutic hypothermia. Pediatr Res 2014;75(3):431–5.
Selewski DT, Jordan BK, Askenazi DJ, Dechert RE, Sarkar S. Acute kidney injury in asphyxiated newborns treated with therapeutic hypothermia. J Pediatr 2013; 162(4):725–729.e1.
Tanigasalam V, Bhat V, Adhisivam B,
Sridhar MG. Does therapeutic hypothermia reduce acute kidney injury among
term neonates with perinatal asphyxia? - a
randomized controlled trial. J Matern Fetal Neonatal Med 2016;29(15):2545–8.
Segar JL, Chock VY, Harer MW, Selewski
DT, Askenazi DJ, On behalf of the Newborn Brain Society Guidelines and
Publications Committee. Fluid
management, electrolytes imbalance and renal management in neonates with
neonatal encephalopathy treated with hypothermia. Semin Fetal Neonatal Med
2021:101261 [Epub ahead of print].
Andrew MJ, Parr JR, Montague-Johnson
C, Laler K, Qi C, Baker B, Sullivan PB. Nutritional intervention and
neurodevelopmental outcome in infants with
suspected cerebral palsy: the Dolphin infant double-blind randomized
controlled trial. Dev Med Child Neurol 2018;60(9):906–13.
van Puffelen E, Vanhorebeek I, Joosten
KFM, Wouters PJ, Van den Berghe G, Verbruggen SCAT. Early versus late
parenteral nutrition in critically ill, term
neonates: a preplanned secondary subgroup analysis of the PEPaNIC
multicentre, randomised controlled trial. Lancet Child Adolesc Health
2018;2(7):505–15.
Fivez T, Kerklaan D, Mesotten D,
Verbruggen S, Wouters PJ, Vanhorebeek I, Debaveye Y, Vlasselaers D, Desmet
L, Casaer MP, Garcia Guerra G, Hanot J,
Joffe A, Tibboel D, Joosten K, Van den Berghe G. Early versus late
parenteral nutrition in critically ill children. N Engl J Med
2016;374(12):1111–22.
Tocco NM, Hodge AE, Jones AA, Wispe JR,
Valentine CJ. Neonatal therapeutic hypothermia-associated hypomagnesemia
during parenteral nutrition therapy.
Nutr Clin Pract 2014;29(2):246–8.
Basu SK, Kaiser JR, Guffey D, Minard
CG, Guillet R, Gunn AJ, CoolCap Study Group. Hypoglycaemia and
hyperglycaemia are associated with unfavourable
outcome in infants with hypoxic ischaemic encephalopathy: a post hoc
analysis of the CoolCap Study. Arch Dis Child Fetal Neonatal Ed
2016;101(2):F149–55.
Montaldo P, Caredda E, Pugliese U,
Zanfardino A, Delehaye C, Inserra E, Capozzi L, Chello G, Capristo C,
Miraglia Del Giudice E, Iafusco D. Continuous
glucose monitoring profile during therapeutic hypothermia in encephalopathic
infants with unfavorable outcome. Pediatr Res 2020;88(2):218–24.
Pinchefsky EF, Hahn CD, Kamino D, Chau
V, Brant R, Moore AM, Tam EWY. Hyperglycemia and glucose variability are
associated with worse brain function
and seizures in neonatal encephalopathy: a prospective cohort study. J
Pediatr 2019;209:23–32.
Tam EW, Haeusslein LA, Bonifacio SL,
Glass HC, Rogers EE, Jeremy RJ, Barkovich AJ, Ferriero DM. Hypoglycemia is
associated with increased risk for
brain injury and adverse neurodevelopmental outcome in neonates at risk for
encephalopathy. J Pediatr 2012;161(1):88–93.
Al Shafouri N, Narvey M, Srinivasan G,
Vallance J, Hansen G. High glucose variability is associated with poor
neurodevelopmental outcomes in neonatal
hypoxic ischemic encephalopathy. J Neonatal Perinat Med 2015;8(2):119–24.
Basu SK, Ottolini K, Govindan V, Mashat S, Vezina G, Wang Y, Ridore M, Chang T, Kaiser JR, Massaro AN. Early glycemic profile is associated with brain injury patterns on magnetic resonance imaging in hypoxic ischemic encephalopathy. J Pediatr 2018;203:137–43.
McKinlay CJD, Alsweiler JM, Anstice NS, Burakevych N, Chakraborty A, Chase JG, Gamble GD, Harris DL, Jacobs RJ, Jiang Y, Paudel N, San Diego RJ, Thompson B, Wouldes TA, Harding JE. Children with hypoglycemia and their later development (CHYLD) study team. Association of neonatal glycemia with neurodevelopmental outcomes at 4.5 years. JAMA Pediatr 2017;171(10):972–83.
Pinchefsky EF, Schneider J, Basu S, Tam EWY, Gale C, On behalf of the Newborn Brain Society Guidelines and Publications Committee. Nutrition and management of glycemia in neonates with neonatal encephalopathy treated with hypothermia. Semin Fetal Neonatal Med 2021:101268 [Epub ahead of print].
Zanelli S, Buck M, Fairchild K. Physiologic and pharmacologic considerations for hypothermia therapy in neonates. J Perinatol 2011;31(6):377–86.
Chang LL, Wynn JL, Pacella MJ, Rossignol CC, Banadera F, Alviedo N, Vargas A, Bennett J, Huene M, Copenhaver N, Sura L, Barnette K, Solomon J, Bliznyuk NA, Neu J, Weiss MD. Enteral feeding as an adjunct to hypothermia in neonates with hypoxic-ischemic encephalopathy. Neonatology 2018;113(4):347–52.
Dabydeen L, Thomas JE, Aston TJ, Hartley H, Sinha SK, Eyre JA. High-energy and -protein diet increases brain and corticospinal tract growth in term and preterm infants after perinatal brain injury. Pediatrics 2008;121(1):148–56.
Gale C, Jeyakumaran D, Battersby C,
Ougham K, Ojha S, Culshaw L, Selby E, Dorling J, Longford N. Nutritional
management in newborn babies receiving
therapeutic hypothermia: two retrospective observational studies using
propensity score matching. Health Technol Assess 2021;25(36):1–106.
Bauman ME, Cheung PY, Massicotte MP. Hemostasis and platelet dysfunction in asphyxiated neonates. J Pediatr 2011;158(2 Suppl):e35–9.
Isweisi E, Moore CM, Hurley T, Sola-Visner
M, McCallion N, Ainle FN, et al., On behalf of the Newborn Brain Society
Guidelines and Publications Committee.
Haematological issues in neonates with neonatal encephalopathy treated with
hypothermia. Semin Fetal Neonatal Med 2021:101270 [Epub ahead of print].
Oncel MY, Erdeve O, Calisici E, Oguz
SS, Canpolat FE, Uras N, Dilmen U. The effect of whole-body cooling on
hematological and coagulation parameters in
asphyxic newborns. Pediatr Hematol Oncol 2013;30(3):246–52.
Martinello KA, Meehan C, Avdic-Belltheus
A, Lingam I, Ragab S, Hristova M, Tann CJ, Peebles D, Hagberg H, Wolfs TGAM,
Klein N, Tachtsidis I, Golay X,
Kramer BW, Fleiss B, Gressens P, Robertson NJ. Acute LPS sensitization and
continuous infusion exacerbates hypoxic brain injury in a piglet model of
neonatal encephalopathy. Sci Rep 2019;9(1):10184.
Morkos AA, Hopper AO, Deming DD, Yellon SM, Wycliffe N, Ashwal S, Sowers LC, Peverini RL, Angeles DM. Elevated total peripheral leukocyte count may identify risk for neurological disability in asphyxiated term neonates. J Perinatol 2007;27 (6):365–70.
Palmer C, Roberts RL, Young PI. Timing
of neutrophil depletion influences longterm neuroprotection in neonatal rat
hypoxic-ischemic brain injury. Pediatr Res
2004;55(4):549–56.
Falck M, Osredkar D, Maes E, Flatebø T, Wood TR, Sabir H, Thoresen M. Hypothermic neuronal rescue from infection-sensitised hypoxic-ischaemic brain injury is pathogen dependent. Dev Neurosci 2017;39(1–4):238–47.
McPherson C, Frymoyer A, Ortinau CM, Miller SP, Groenendaal F, on behalf of the Newborn Brain Society Guidelines and Publications Committee. Management of comfort and sedation in neonates with neonatal encephalopathy treated with therapeutic hypothermia. Semin Fetal Neonatal Med 2021 [Epub ahead of print].
Craig A, Deerwester K, Fox L, Jacobs
J, Evans S. Maternal holding during therapeutic hypothermia for infants with
neonatal encephalopathy is feasible.
Acta Paediatr 2019;108:1597–602.
Biskop E, Paulsdotter T, Hellstrom
Westas L, Agren J, Blomqvist YT. Parental participation during therapeutic
hypothermia for neonatal hypoxic-ischemic
encephalopathy. Sex Reprod Healthc 2019;20:77–80.
Tasci B, Kuzlu Ayyildiz T. The calming effect of maternal breast milk odor on term infant: a randomized controlled trial. Breastfeed Med 2020;15(11):724–30.
B¨acke P, Hjelte B, Hellstr¨om Westas L, Ågren J, Thernstr¨om Blomqvist Y. When all I wanted was to hold my baby-The experiences of parents of infants who received therapeutic hypothermia. Acta Paediatr 2021;110(2):480–6.
Filippa M, Poisbeau P, Mairesse J, Monaci MG, Baud O, Hüppi P, Grandjean D, Kuhn P. Pain, parental involvement, and oxytocin in the neonatal intensive care unit. Front Psychol 2019;10:715.
Liow N, Montaldo P, Lally PJ,
Teiserskas J, Bassett P, Oliveira V, Mendoza J, Slater R, Shankaran S,
Thayyil S. Preemptive morphine during therapeutic
hypothermia after neonatal encephalopathy: a secondary analysis. Ther
Hypothermia Temp Manag 2020;10(1):45–52.
Sabir H, Dingley J, Scull-Brown E, Chakkarapani E, Thoresen M. Fentanyl induces cerebellar internal granular cell layer apoptosis in healthy newborn pigs. Front Neurol 2018;9:294.
Simbruner G, Mittal RA, Rohlmann F,
Muche R. neo.nEURO.network Trial Participants. Systemic hypothermia after
neonatal encephalopathy: outcomes of
neo. nEURO.network RCT. Pediatrics. 2010;126(4):e771–8.
Vutskits L, Xie Z. Lasting impact of general anaesthesia on the brain: mechanisms and relevance. Nat Rev Neurosci 2016;17(11):705–17.
Favi´e LMA, Groenendaal F, van den Broek MPH, Rademaker CMA, de Haan TR, van Straaten HLM, Dijk PH, van Heijst A, Dudink J, Dijkman KP, Rijken M, Zonnenberg IA, Cools F, Zecic A, van der Lee JH, Nuytemans DHGM, van Bel F, Egberts TCG, Huitema ADR, PharmaCool study group. Pharmacokinetics of morphine in encephalopathic neonates treated with therapeutic hypothermia. PLoS One 2019;14(2):e0211910.
Frymoyer A, Bonifacio SL, Drover DR, Su F, Wustoff CJ, Van Meurs KP. Decreased morphine clearance in neonates with hypoxic ischemic encephalopathy receiving hypothermia. J Clin Pharmacol 2017;57(1):64–76.
van den Broek MP, van Straaten HL, Huitema AD, Egberts T, Toet MC, de Vries LS, Rademaker K, Groenendaal F. Anticonvulsant effectiveness and hemodynamic safety of midazolam in full-term infants treated with hypothermia. Neonatology 2015;107(2):150–6.
McAdams RM, Pak D, Lalovic B, Phillips
B, Shen DD. Dexmedetomidine pharmacokinetics in neonates with hypoxic-ischemic
encephalopathy receiving
hypothermia. Anesthesiol Res Pract 2020;2020:2582965.
Degos V, Charpentier TL, Chhor V,
Brissaud O, Lebon S, Schwendimann L, Bednareck N, Passemard S, Mantz J,
Gressens P. Neuroprotective effects of
dexmedetomidine against glutamate agonist-induced neuronal cell death are
related to increased astrocyte brain-derived neurotrophic factor expression.
Anesthesiology 2013;118(5):1123–32.
Ma D, Hossain M, Rajakumaraswamy N, Arshad M, Sanders RD, Franks NP, Maze M. Dexmedetomidine produces its neuroprotective effect via the alpha 2Aadrenoceptor subtype. Eur J Pharmacol 2004 Oct 11;502(1–2):87–97.
Tobias JD. Bradycardia during dexmedetomidine and therapeutic hypothermia. J Intensive Care Med 2008;23(6):403–8.
DeLaGarza-Pineda O, Mailo JA, Boylan G, Chau V, Glass HC, Mathur AM, et al., On behalf of the Newborn Brain Society Guidelines and Publications Committee. Management of seizures in neonates with neonatal encephalopathy treated with hypothermia. Semin Fetal Neonatal Med 2021 [Epub ahead of print].
Pressler RM, Cilio MR, Mizrahi EM, Mosh´e SL, Nunes ML, Plouin P, Vanhatalo S, Yozawitz E, de Vries LS, Puthenveettil Vinayan K, Triki CC, Wilmshurst JM, Yamamoto H, Zuberi SM. The ILAE classification of seizures and the epilepsies: modification for seizures in the neonate. Position paper by the ILAE Task Force on Neonatal Seizures. Epilepsia 2021;62(3):615–28.
Shellhaas RA, Chang T, Tsuchida T, Scher MS, Riviello JJ, Abend NS, Nguyen S, Wusthoff CJ, Clancy RR. The American clinical neurophysiology society’s guideline on continuous electroencephalography monitoring in neonates. J Clin Neurophysiol 2011;28(6):611–7.
Benedetti GM, Vartanian RJ, McCaffery H, Shellhaas RA. Early electroencephalogram background could guide tailored duration of monitoring for neonatal encephalopathy treated with therapeutic hypothermia. J Pediatr 2020;221:81–87.e1.
Glass HC, Shellhaas RA, Wusthoff CJ,
Chang T, Abend NS, Chu CJ, Cilio MR, Glidden DV, Bonifacio SL, Massey S,
Tsuchida TN, Silverstein FS, Soul JS.
Neonatal seizure registry study group. Contemporary profile of seizures in
neonates: a prospective cohort study. J Pediatr 2016;174:98–103.e1.
Hellstr¨om-Westas L, Boylan G, Ågren
J. Systematic review of neonatal seizure management strategies provides
guidance on anti-epileptic treatment. Acta
Paediatr 2015;104(2):123–9.
Sharpe C, Reiner GE, Davis SL, Nespeca M, Gold JJ, Rasmussen M, Kuperman R, Harbert MJ, Michelson D, Joe P, Wang S, Rismanchi N, Le NM, Mower A, Kim J, Battin MR, Lane B, Honold J, Knodel E, Arnell K, Bridge R, Lee L, Ernstrom K, Raman R, Haas RH. NEOLEV2 investigators. Levetiracetam versus phenobarbital for neonatal seizures: a randomized controlled trial. Pediatrics 2020;145(6): e20193182.
Shellhaas RA, Chang T, Wusthoff CJ,
Soul JS, Massey SL, Chu CJ, Cilio MR, Bonifacio SL, Abend NS, Tsuchida TN,
Glass HC. Neonatal seizure registry study
group. Treatment duration after acute symptomatic seizures in neonates: a
multicenter cohort study. J Pediatr 2017;181:298–301.e1.
Srinivasakumar P, Zempel J, Trivedi S,
Wallendorf M, Rao R, Smith B, Inder T, Mathur AM. Treating EEG seizures in
hypoxic ischemic encephalopathy: a
randomized controlled trial. Pediatrics 2015;136(5):e1302–9.
van Rooij LG, Toet MC, van Huffelen
AC, Groenendaal F, Laan W, Zecic A, de Haan T, van Straaten IL, Vrancken S,
van Wezel G, van der Sluijs J, Ter Horst H,
Gavilanes D, Laroche S, Naulaers G, de Vries LS. Effect of treatment of
subclinical neonatal seizures detected with aEEG: randomized, controlled
trial. Pediatrics 2010;125(2):e358–66.
Fitzgerald MP, Kessler SK, Abend NS.
Early discontinuation of antiseizure medications in neonates with hypoxic-ischemic
encephalopathy. Epilepsia 2017;
58(6):1047–53.
Glass HC, Grinspan ZM, Shellhaas RA. Outcomes after acute symptomatic seizures in neonates. Semin Fetal Neonatal Med 2018;23(3):218–22.
Glass HC, Soul JS, Chang T, Wusthoff
CJ, Chu CJ, Massey SL, Abend NS, Lemmon M, Thomas C, Numis AL, Guillet R,
Sturza J, McNamara NA, Rogers EE,
Franck LS, McCulloch CE, Shellhaas RA. Safety of early discontinuation of
antiseizure medication after acute symptomatic neonatal seizures. JAMA
Neurol
2021;78(7):817–25.
Wisnowski JL, Wintermark P, Bonifacio
SL, Smyser CD, Barkovich AJ, Edwards AD, et al., On behalf of the newborn
brain society guidelines and
publications committee. Neuroimaging in the term newborn with neonatal
encephalopathy. Semin Fetal Neonatal Med 2021 [Epub ahead of print].
Epelman M, Daneman A, Kellenberger CJ, Aziz A, Konen O, Moineddin R, Whyte H, Blaser S. Neonatal encephalopathy: a prospective comparison of head US and MRI. Pediatr Radiol 2010;40(10):1640–50.
Agut T, Leon M, Rebollo M, Muchart J, Arca G, Garcia-Alix A. Early identification of brain injury in infants with hypoxic ischemic encephalopathy at high risk for severe impairments: accuracy of MRI performed in the first days of life. BMC Pediatr 2014;14:177.
Boudes E, Tan X, Saint-Martin C, Shevell M, Wintermark P. MRI obtained during versus after hypothermia in asphyxiated newborns. Arch Dis Child Fetal Neonatal Ed 2015;100:F238–42.
Chakkarapani E, Poskitt KJ, Miller SP, et al. Reliability of early magnetic resonance imaging (MRI) and necessity of repeating MRI in noncooled and cooled infants with neonatal encephalopathy. J Child Neurol 2016;31:553–9.
Charon V, Proisy M, Bretaudeau G, et al. Early MRI in neonatal hypoxic-ischaemic encephalopathy treated with hypothermia: prognostic role at 2-year follow-up. Eur J Radiol 2016;85:1366–74.
Skranes JH, Cowan FM, Stiris T, Fugelseth D, Thoresen M, Server A. Brain imaging in cooled encephalopathic neonates does not differ between four and 11 days after birth. Acta Paediatr 2015;104:752–8.
Wintermark P, Hansen A, Soul J, Labrecque M, Robertson RL, Warfield SK. Early versus late MRI in asphyxiated newborns treated with hypothermia. Arch Dis Child Fetal Neonatal Ed 2011;96:F36–44.
Wintermark P, Labrecque M, Warfield SK,
DeHart S, Hansen A. Can induced hypothermia be assured during brain MRI in
neonates with hypoxic-ischemic
encephalopathy? Pediatr Radiol 2010;40:1950–4.
Wu TW, McLean C, Friedlich P, Grimm J,
Bluml S, Seri I. Maintenance of wholebody therapeutic hypothermia during
patient transport and magnetic resonance
imaging. Pediatr Radiol 2014;44:613–7.
Lemmon ME, Wusthoff CJ, Boss RD, Rasmussen LA, On behalf of the Newborn Brain Society Guidelines and Publications Committee. Ethical considerations in the care of encephalopathic neonates treated with therapeutic hypothermia. Semin Fetal Neonatal Med 2021:101258 [Epub ahead of print].
Pilon B, Craig AK, Lemmon ME, Goeller A, On behalf of Newborn Brain Society Guidelines and Publications Committee. Supporting families in their child’s journey with neonatal encephalopathy and therapeutic hypothermia. Semin Fetal Neonatal Med 2021:101278 [Epub ahead of print].
O’Brien K, Robson K, Bracht M, Cruz M, Lui K, Alvaro R, da Silva O, Monterrosa L, Narvey M, Ng E, Soraisham A, Ye XY, Mirea L, Tarnow-Mordi W, Lee SK, FICare Study Group and FICare Parent Advisory Board. Effectiveness of Family Integrated Care in neonatal intensive care units on infant and parent outcomes: a multicentre, multinational, cluster-randomised controlled trial. Lancet Child Adolesc Health 2018;2(4):245–54.
DeMaster D, Bick J, Johnson U, Montroy
JJ, Landry S, Duncan AF. Nurturing the preterm infant brain: leveraging
neuroplasticity to improve neurobehavioral
outcomes. Pediatr Res 2019;85(2):166–75.
Maguire CM, Walther FJ, Sprij AJ, Le
Cessie S, Wit JM, Veen S. Leiden Developmental Care Project. Effects of
individualized developmental care in a
randomized trial of preterm infants <32 weeks. Pediatrics
2009;124(4):1021–30.
Feldman R, Rosenthal Z, Eidelman AI. Maternal-preterm skin-to-skin contact enhances child physiologic organization and cognitive control across the first 10 years of life. Biol Psychiatr 2014;75(1):56–64.
Procianoy RS, Mendes EW, Silveira RC.
Massage therapy improves neurodevelopment outcome at two years corrected age
for very low birth weight
infants. Early Hum Dev 2010;86(1):7–11.
Braid S, Bernstein J. Improved cognitive development in preterm infants with shared book reading. Neonatal Netw 2015;34(1):10–7.
Chorna O, Filippa M, De Almeida JS,
Lordier L, Monaci MG, Hüppi P, Grandjean D, Guzzetta A. Neuroprocessing
mechanisms of music during fetal and
neonatal development: a role in neuroplasticity and neurodevelopment. Neural
Plast 2019;2019:3972918.
Shellhaas RA, Burns JW, Barks JDE, Hassan F, Chervin RD. Maternal voice and infant sleep in the neonatal intensive care unit. Pediatrics 2019;144(3): e20190288.
Smith SW, Ortmann AJ, Clark WW. Noise in the neonatal intensive care unit: a new approach to examining acoustic events. Noise Health 2018;20(95):121–30.
Shellhaas RA, Burns JW, Hassan F, Carlson MD, Barks JDE, Chervin RD. Neonatal sleep-wake analyses predict 18-month neurodevelopmental outcomes. Sleep 2017;40(11):zsx144.
[160] Forcada-Guex M, Pierrehumbert B, Borghini A, Moessinger A, Muller-Nix C. Early dyadic patterns of mother-infant interactions and outcomes of prematurity at 18 months. Pediatrics 2006;118(1):e107–14.
Rodd C, Schwieger-Briel A, Hagmann C, on behalf of the Newborn Brain Society Guidelines and Publications Committee. Subcutaneous fat necrosis associated with hypercalcemia in neonates with neonatal encephalopathy treated with therapeutic hypothermia. Semin Fetal Neonatal Med 2021:101269 [Epub ahead of print].
Courteau C, Samman K, Ali N, Riley P,
Wintermark P. Macrosomia and haemodynamic instability may represent risk
factors for subcutaneous fat necrosis
in asphyxiated newborns treated with hypothermia. Acta Paediatr 2016;105(9):
e396–405.
Filippi L, Catarzi S, Padrini L,
Fiorini P, la Marca G, Guerrini R, Donzelli GP. Strategies for reducing the
incidence of skin complications in newborns treated
with whole-body hypothermia. J Matern Fetal Neonatal Med 2012;25(10):
2115–21.
Jary S, Lee-Kelland R, Tonks J, Cowan
FM, Thoresen M, Chakkarapani E. Motor performance and cognitive correlates
in children cooled for neonatal
encephalopathy without cerebral palsy at school age. Acta Paediatr 2019;108
(10):1773–80.
Lee-Kelland R, Jary S, Tonks J, Cowan FM, Thoresen M, Chakkarapani E. Schoolage outcomes of children without cerebral palsy cooled for neonatal hypoxicischaemic encephalopathy in 2008-2010. Arch Dis Child Fetal Neonatal Ed 2020; 105(1):8–13.
Marlow N, Shankaran S, Rogers EE,
Maitre NL, Smyser CD, on behalf of the Newborn Brain Society Guidelines and
Publications Committee. Neurological and
developmental outcomes following neonatal encephalopathy treated with
therapeutic hypothermia. Semin Fetal Neonatal Med 2021:101274 [Epub ahead
of print], on behalf of the.
Shankaran S, Laptook AR, Pappas A,
McDonald SA, Das A, Tyson JE, Poindexter BB, Schibler K, Bell EF, Heyne RJ,
Pedroza C, Bara R, Van Meurs KP,
Huitema CMP, Grisby C, Devaskar U, Ehrenkranz RA, Harmon HM, Chalak LF,
DeMauro SB, Garg M, Hartley-McAndrew ME, Khan AM, Walsh MC, Ambalavanan N,
Brumbaugh JE, Watterberg KL, Shepherd EG, Hamrick SEG, Barks J, Cotten CM,
Kilbride HW, Higgins RD, Eunice Kennedy Shriver National Institute of
Child Health and Human Development Neonatal Research Network. Effect of
depth and duration of cooling on death or disability at age 18 Months
among neonates with hypoxic-ischemic encephalopathy: a randomized clinical
trial. J Am Med Assoc 2017;318(1):57–67.
Schreglmann M, Ground A, Vollmer B,
Johnson MJ. Systematic review: long-term cognitive and behavioural outcomes
of neonatal hypoxic-ischaemic
encephalopathy in children without cerebral palsy. Acta Paediatr
2020;109(1): 20–30.
Novak I, Morgan C, Adde L, Blackman J, Boyd RN, Brunstrom-Hernandez J, Cioni G, Damiano D, Darrah J, Eliasson AC, de Vries LS, Einspieler C, Fahey M, Fehlings D, Ferriero DM, Fetters L, Fiori S, Forssberg H, Gordon AM, Greaves S, Guzzetta A, Hadders-Algra M, Harbourne R, Kakooza-Mwesige A, Karlsson P, Krumlinde-Sundholm L, Latal B, Loughran-Fowlds A, Maitre N, McIntyre S, Noritz G, Pennington L, Romeo DM, Shepherd R, Spittle AJ, Thornton M, Valentine J, Walker K, White R, Badawi N. Early, accurate diagnosis and early intervention in cerebral palsy: advances in diagnosis and treatment. JAMA Pediatr 2017;171(9):897–907.
Cramer SC, Sur M, Dobkin BH, O’Brien
C, Sanger TD, Trojanowski JQ, Rumsey JM, Hicks R, Cameron J, Chen D, Chen WG,
Cohen LG, deCharms C,
Duffy CJ, Eden GF, Fetz EE, Filart R, Freund M, Grant SJ, Haber S, Kalivas
PW, Kolb B, Kramer AF, Lynch M, Mayberg HS, McQuillen PS, Nitkin R, Pascual-
Leone A, Reuter-Lorenz P, Schiff N, Sharma A, Shekim L, Stryker M, Sullivan
EV, Vinogradov S. Harnessing neuroplasticity for clinical applications.
Brain 2011; 134(Pt 6):1591–609.
Chakkarapani AA, Aly H, Benders M, Cotten CM, El-Dib M, Gressens P, et al., on behalf of the Newborn Brain Society Guidelines and Publications Committee. Therapies for neonatal encephalopathy: targeting the latent, secondary and tertiary phases of evolving brain injury. Semin Fetal Neonatal Med 2021:101256 [Epub ahead of print].
Davidson JO, Gonzalez F, Gressens P, Gunn AJ, on behalf of the Newborn Brain Society Guidelines and Publications Committee. Update on mechanisms of the pathophysiology of neonatal encephalopathy. Semin Fetal Neonatal Med 2021: 101267 [Epub ahead of print].
Azzopardi D, Robertson NJ, Bainbridge A, Cady E, Charles-Edwards G, Deierl A, Fagiolo G, Franks NP, Griffiths J, Hajnal J, Juszczak E, Kapetanakis B, Linsell L, Maze M, Omar O, Strohm B, Tusor N, Edwards AD. Moderate hypothermia within 6 h of birth plus inhaled xenon versus moderate hypothermia alone after birth asphyxia (TOBY-Xe): a proof-of-concept, open-label, randomised controlled trial. Lancet Neurol 2016;15(2):145–53.
Gagne-Loranger M, Sheppard M, Ali N, Saint-Martin C, Wintermark P. Newborns referred for therapeutic hypothermia: association between initial degree of encephalopathy and severity of brain injury (what about the newborns with mild encephalopathy on admission?). Am J Perinatol 2016;33(2):195–202.
El-Dib M, Inder TE, Chalak LF, Massaro AN, Thoresen M, Gunn AJ. Should therapeutic hypothermia be offered to babies with mild neonatal encephalopathy in the first 6 hafter birth. Pediatr Res 2019;85(4):442–8.
Synnes A, Luu TM, Moddemann D, Church P, Lee D, Vincer M, Ballantyne M, Majnemer A, Creighton D, Yang J, Sauve R, Saigal S, Shah P, Lee SK. Canadian Neonatal Network and the Canadian Neonatal Follow-Up Network. Determinants of developmental outcomes in a very preterm Canadian cohort. Arch Dis Child Fetal Neonatal Ed 2017;102(3). F235-F234.