Sepsis de Inicio precoz
Septiembre 2021
Sepsis de inicio precoz
Karen M. Puopolo
Clinics in Perinatology 48 (2021)
Introducción
Sepsis neonatal de inicio precoz (EOS) : Infección bacteriana invasiva detectada menos de 72 horas después del nacimiento (casos pueden presentarse hasta 6 días después del nacimiento).
Incidencia general EOS en prematuros y RNT : 0.7 - 0.8 casos por 1.000 nacidos vivos.
Identificación y manejo de bebés en riesgo de EOS se hace por screening estandarizados
Epidemiología y microbiología de Sepsis de inicio precoz en Recién nacidos a término
Incidencia de EOS entre recién nacidos a término = 0.5 casos por 1000 nacidos vivos.
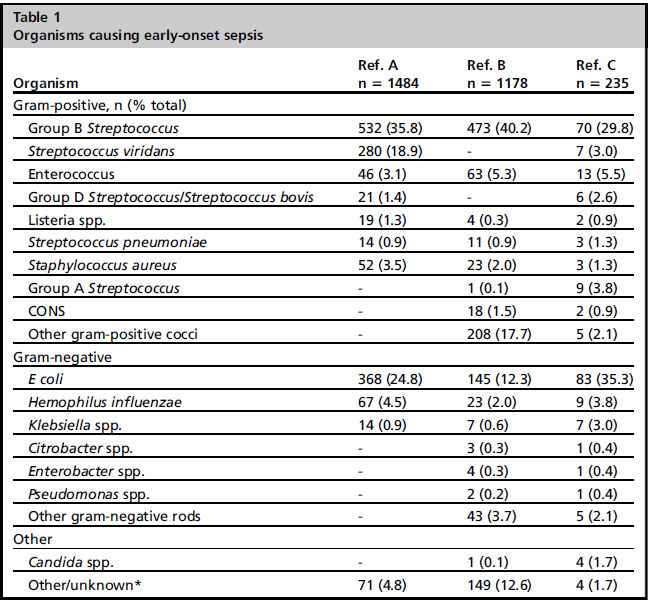
Patógenos más comunes que causan EOS son Estreptococo del grupo B (GBS) seguido de Escherichia coli.
E. coli es organismo más comúnmente aislado entre prematuros de muy bajo peso al nacer.
Tabla 1 muestra otros patógenos aislados en casos de EOS en RNT.
Incidencia de EOS por GBS en RNT 0.17 por 1000 n.v. (2006-2015) y de E. coli 0.08 por 1000 nv
Tasa de letalidad ajustada al riesgo EOS por año en RNT fue 2%, variando de 0% para casos por GBS al 9% para causados por E. coli.
Table 1.- Organismos causantes de sepsis de inicio precoz

Fisiopatología
EOS se transmite verticalmente de madre a hijo sea por vía transplacentaria (raramente) o más comúnmente, durante trabajo de parto y parto con colonización del feto / recién nacido con microorganismos gastrointestinales y genitourinarios maternos que posteriormente causan infección invasiva en recién nacido.
Microbiología de EOS refleja colonización de origen materno poco antes o en momento del parto ==> medidas de prevención es identificación de madres en riesgo y posterior administración de antibióticos durante el parto para alterar colonización patogénica materno-fetal o como tratamiento temprano del feto a través de la madre.
Métodos preventivos : screening universal de EGB en embarazadas entre 36 y 37 semanas gestación y administración de profilaxis antibiótica intraparto (PAI) a mujeres colonizadas por GBS o a mujeres con signos y síntomas de infección intraamniótica.
Vigilancia nacional de EOS por EGB ==> 1.277 casos EOS por EGB, 48% ocurrió en mujeres que no cumplían con los criterios para recibir PAI en EGB, 22% en mujeres que cumplían con los criterios pero no habían iniciado la PAI y 30% en mujeres que recibieron una duración o un contenido inadecuados de la PAI ==> no todos los casos se capturan con las estrategias de screening actuales o se pueden prevenir.
Antibióticos
Todas las bacterias GBS siguen siendo sensibles a penicilina y ampicilina
Se ha informado prevalencia creciente de resistencia a Clindamicina (21- 47% de aislamientos) y eritromicina (49-58% de aislamientos)
E. coli que causan EOS , tienen más probabilidades de ser resistentes a antibióticos comunes de primera línea (ampicilina y gentamicina),
255 casos de E. coli en bebés de todas las gestaciones : 66% fueron resistentes a ampicilina y 10% a gentamicina.
Factores de riesgo y presentación clínica de sepsis de inicio precoz
Transmisión de madre a hijo de microorganismos colonizadores por parto vaginal normal.
Casos de EOS se asocian con colonización e infección patógena ==> factores clínicos que representan oportunidad de tal colonización :
Ruptura prolongada de membrana
Fiebre materna intraparto
Infección intraamniótica
Duración prolongada de la rotura de membranas
Hallazgos clínicos
Estado asintomático en período posterior al parto reduce las odds o probabilidades de EOS.
235 casos de EOS : 93% de neonatos (incluyendo 85% y 94% de recién nacidos a término con infección por EGB y E. coli, respectivamente) tenían signos documentados de infección en los primeros 3 días después del nacimiento.
Signos :
Taquipnea (> 60 respiraciones / min sostenidas durante 30 minutos)
Aumento del trabajo respiratorio y taquicardia (> 160 latidos / min)
Acidosis e hipotensión
Estudio de 81 casos de EOS a término nacidos de mujeres con diagnóstico de corioamnionitis, la mayoría de las cuales fueron tratadas con antibióticos empíricos dentro de las 6 horas posteriores al nacimiento, informó que una mayor proporción de bebés (22%) con EOS permanecieron asintomáticos durante las primeras 72 horas. 27
Evaluación del riesgo
Protocolos de screening con target de pacientes antes de que se manifieste la enfermedad deben considerar los daños del screening versus los beneficios de la detección temprana.
A medida que disminuya la incidencia de la enfermedad, cambiará el riesgo o beneficio del screening .
Se pueden calcular los números necesarios para tratar o dañar, pero la elección de un umbral de riesgo aceptable es subjetiva.
Evaluación del riesgo de EOS puede implicar la consideración de
Factores de riesgo perinatal
Examen clínico
Resultados de las pruebas de laboratorio.
Estos factores no contribuyen igualmente a la toma de decisiones: la enfermedad crítica a menudo reemplaza a otros factores, al menos para el manejo inmediato.
De manera similar, el aislamiento de un patógeno de un hemocultivo generalmente reemplaza a los marcadores inmunes del huésped normal y al examen clínico tranquilizador.
Decisión de iniciar antibióticos en recién nacidos con buena apariencia ==> 3 enfoques diferentes :
Cada enfoque consiste en un conjunto de pasos que incorporan información de la historia y / o el examen en un flujo de trabajo estandarizado para ayudar al médico a identificar consistentemente a los bebés en riesgo.
Los enfoques difieren en cómo se incorporan factores de riesgo, umbrales de riesgo procesables y acciones clínicas recomendadas.
a.- Enfoque categórico
Factores de riesgo :
Se ordenan secuencialmente, en un orden que permite una vía de manejo de "si ésto, entonces aquello".
Se visualizan fácilmente como diagramas de flujo
Edad gestacional
Duración de la rotura de la membrana
Sospecha de corioamnionitis materna
Estado materno de GBS
Adecuación de PAI
Estado clínico del lactante
Factores de riesgo se consideran de manera dicotómica con respuestas sí o no, requiriendo la creación de puntos de corte para variables continuas (tales como edad gestacional < 35 o < 37 semanas y duración de la rotura de la membrana ≥ 18 horas).
Ventajas del enfoque categórico incluyen la familiaridad y facilidad de uso.
Desventajas son pérdida de información en la dicotomización de variables y una presentación simplificada de las relaciones de los factores de riesgo que pueden ser, en realidad, complejas.
Preocupación principal : sobreidentificación de bebés en riesgo debido a prevalencia de factores de riesgo incluídos en comparación con la incidencia de EOS, con consecuencias asociadas de separación de madre / bebé y utilización de recursos.
b.- Estimación del riesgo multivariado
Variables asociadas con un mayor riesgo de EOS pueden no ocurrir una a la vez, y cuando ocurren juntas pueden tener interacciones complejas.
Para un recién nacido con múltiples factores, el riesgo de EOS es diferente del estimado al considerar cada variable perinatal por separado.
Calculadora de EOS neonatal de Kaiser Permanente (https://neonatalsepsiscalculator.kaiserpermanente.org/) combina 2 modelos de predicción multivariable que incorporan factores de riesgo perinatal, incluyendo administración de antibióticos maternos intraparto y evolución de condición clínica del bebé, para calcular la estimación del riesgo para un bebé individual.
Modelo perinatal utiliza incidencia conocida de EOS en población a término e incorpora 5 factores que se sabe afectan el riesgo de infección (edad gestacional, duración de rotura de membrana, temperatura materna más alta durante trabajo de parto, tipo y momento de administración de antibióticos maternos durante trabajo de parto y estado materno de SGB) para dar probabilidad de EOS al momento del nacimiento de ese bebé.
Usuario luego clasifica el examen clínico en evolución durante las próximas 12 a 24 horas en enfermedad clínica, equívoca o de buena apariencia, basados en definiciones preespecificadas e incorpora el modelo de riesgo por condición clínica para obtener probabilidad final de EOS.
Modelos de calculadora no utilizan resultados de pruebas de laboratorio.
Probabilidad de EOS se expresa como número previsto de casos de EOS por 1000 nacidos vivos.
Recomendaciones en sitio web de Calculadora de riesgo de sepsis son obtener hemocultivo y usar observación clínica estrecha si estimación de riesgo final es mayor de 1 por 1000 nv y administrar tratamiento antibiótico empírico si estimación de riesgo final es mayor de 3 por 1000 nv .
Probabilidad de EOS calculada por modelos se basa en un estudio robusto de casos y controles, mientras que las recomendaciones para acciones en umbrales particulares fueron establecidas por consenso de expertos y posteriormente validadas prospectivamente en un gran estudio de implementación.
Comparación del Enfoque categórico con Calculadora reduce evaluaciones de EOS de 14% al 5% y uso de antibióticos en primeras 24 horas después del nacimiento del 5% al 3% .
Estudio comparó más de 90.000 neonatos manejados con un enfoque categórico con más de 50.000 bebés manejados con la calculadora y encontraron tasas similares de EOS y enfermedad clínica grave de EOS.
Este estudio también demostró que después del alta hospitalaria del nacimiento, la tasa de readmisión con EOS confirmada por cultivo en la semana posterior al nacimiento fue muy baja (aproximadamente 5 casos por 100.000 nv) y no fue diferente cuando se usaron enfoques categóricos o de calculadora.
Metanálisis de 13 estudios encontró que adopción de Calculadora de riesgo de sepsis se asoció con reducción significativa en uso de antibióticos empíricos, sin diferencias en la proporción de casos perdidos (definidos como recién nacidos con EOS que no iniciaron la terapia con antibióticos dentro de las 24 horas posteriores al nacimiento).
Por lo tanto, en el contexto de perfiles de seguridad similares, el modelo de riesgo multivariante fue significativamente más eficiente, rentable y redujo la exposición innecesaria a antibióticos para los neonatos.
c.- Observación clínica seriada
Tercera estrategia para evaluación de recién nacidos que tienen EOS se basa en observación clínica estrecha de recién nacidos para lograr el reconocimiento oportuno de aquellos que están o que se enferman con EOS.
Este enfoque está justificado por estudios que demuestran que recién nacidos a término que no presentan signos clínicos de enfermedad rara vez tienen EOS.
Incluso entre el grupo de alto riesgo de neonatos expuestos a corioamnionitis materna, tasa de EOS es de aproximadamente 3 por 1000 nv o menos entre aquellos que parecen estar bien al nacer
Se han recomendado estrategias basadas en la observación clínica estrecha sin uso de antibióticos empíricos basados en factores de riesgo maternos, para escenarios muy específicos en Reino Unido y han sido aprobadas como opción para evaluación de riesgos de EOS en EEUU.
Detalles específicos de Estrategias basadas en la observación varían entre las diferentes implementaciones, pero todas comparten características comunes que se superponen con los componentes de Calculadora de riesgo de sepsis.
Todas incorporan programas estructurados de exámenes seriados de recién nacidos durante las primeros 12 a 48 horas después del nacimiento, con mayor frecuencia durante primeras 6 a 8 horas y menos a partir de entonces.
Implementación en hospitales de Universidad de Stanford en Estados Unidos incluye exámenes seriados de todos los recién nacidos ≥ de 35 semanas de gestación, mientras que otros enfoques se enfocan solo en aquellos expuestos a corioamnionitis o con factores de riesgo y profilaxis intraparto inadecuada.
Los componentes de las evaluaciones difieren (no son tan específicos como los de Calculadora de riesgo de sepsis), pero generalmente incluyen color y perfusión de piel, signos de dificultad respiratoria, inestabilidad de temperatura y bienestar general (letargo, irritabilidad, convulsiones) .
Criterios para la evaluación diagnóstica y / o el tratamiento basados en los hallazgos del examen varían según el centro.
Los reportes de estrategias basadas en la observación abordan la seguridad y la eficacia.
Se comparó a recién nacidos a término de buena apariencia en épocas de un año antes (7.628 neonatos) y después (7.611 neonatos) de la transición de estrategia de riesgo categórico con observación en serie en Friuli-Venecia Julia.
Tasas de exámenes de laboratorio disminuyeron de 6.3 % al 0.5% y el tratamiento con antibióticos del 1.2% al 0.5% .
El análisis retrospectivo de 1.000 neonatos en riesgo con apariencia saludable nacidos a las 35 semanas de gestación o más en un solo centro en Emilia-Romagna mostró una reducción de pruebas de laboratorio de 11.6% a 1.6% y tratamiento con antibióticos de 2.8% a 0.6% después de la adopción de una estrategia basada en la observación.
En un análisis posterior de EOS en la cohorte de nacimiento de esta región después de la adopción de estrategias basadas en observación (48 casos entre 265.508 nv ≥ de 35 semanas de gestación durante 2010-2016), ningún caso de recién nacido tuvo un resultado adverso como resultado de esta estrategia.
Sin embargo, 75% de centros también obtuvieron hemocultivos y recuentos de glóbulos blancos al nacer en recién nacidos expuestos a fiebre intraparto.
En particular, se consideró que 15 bebés con EOS “no estaban en riesgo” y se identificaron cuando presentaban signos de enfermedad, enfatizando el valor de la observación clínica seriada en la identificación de recién nacidos infectados sin factores de riesgo perinatal específicos.
Una experiencia de un solo centro informada en California es consistente con estas observaciones.
Entre los bebés nacidos de mujeres con corioamnionitis clínica, la adopción de un protocolo basado en la observación redujo la exposición a antibióticos del 100% (de acuerdo con las recomendaciones de Centros para Control y Prevención de Enfermedades [CDC] ) al 21.0% y posteriormente al 10.3% .
En toda la cohorte de 20.394 neonatos de 35 semanas de gestación o más nacidos después de la adopción del protocolo basado en la observación, la exposición a los antibióticos se redujo en 63%.
Los 7 bebés con EOS nacidos durante el período del protocolo basado en la observación se identificaron en base al desarrollo de los signos clínicos de la enfermedad, y no se atribuyeron resultados adversos a la estrategia basada en la observación.
En esta cohorte, el tratamiento basado en los signos clínicos de la enfermedad todavía resultó en la administración de antibióticos a 120 bebés por cada caso de EOS , lo que indica una necesidad persistente de herramientas que puedan ayudar a identificar a bebés que no tienen EOS a pesar de no verse bien.
Estudios de Laboratorio
Hemocultivo
EOS se diagnostica tradicionalmente mediante aislamiento de organismos patógenos de sitios normalmente estériles, principalmente sangre y líquido cefalorraquídeo (LCR).
En primeras 72 horas después del nacimiento, rendimiento de Urocultivos es muy bajo, y éstos no están indicados.
Los cultivos de hisopados de superficie (oído, piel, muñón umbilical) o muestras de aspirado gástrico no son informativos.
Si se obtienen volúmenes adecuados de sangre (1 ml), las técnicas de hemocultivo actuales detectan de manera confiable la bacteriemia a niveles de 1 a 10 unidades formadoras de colonias por mililitro de sangre.
El nivel de bacteriemia por debajo de este límite de detección es raro en los recién nacidos bacteriémicos, en los que la densidad de bacteriemia supera las 10 unidades formadoras de colonias / ml en el 90% de los casos.
Inoculación de 2 frascos de cultivo puede ayudar a distinguir las especies contaminantes de las infecciones verdaderas, pero la mayoría de los médicos no obtienen muestras pareadas de sitios separados para evaluación de EOS.
Cultivos anaeróbicos optimizan la recuperación de patógenos estrictamente anaeróbicos, que pueden representar aproximadamente 15% de los casos de EOS en recién nacidos de muy bajo peso al nacer, pero la incertidumbre sobre el papel de las infecciones anaeróbicas en los recién nacidos a término ha obstaculizado la adopción de cultivos anaeróbicos de rutina en esta población.
Laboratorio informa el crecimiento de un organismo después de 36 horas o menos de incubación en 95% de cultivos que dan positivo, lo que justifica las decisiones de interrumpir la terapia empírica en ese momento.
Se estima que continuar la administración de antibióticos más allá de las 36 horas para evitar la interrupción del tratamiento en bebés con bacteriemia (aún no informada) requiere el tratamiento de casi 3.600 bebés que finalmente tienen cultivos definitivamente estériles.50
Aunque un resultado positivo del hemocultivo es criterio de consenso para diagnóstico de EOS, pueden producirse resultados tanto falsos positivos como falsos negativos.
Resultados falsos positivos suelen deberse al aislamiento de organismos no patógenos introducidos durante la recogida de muestras.
El aislamiento de patógenos tales como GBS o E. coli de bebés que se mantienen bien y tienen cultivos de seguimiento estériles antes del tratamiento con antibióticos sugiere que la bacteriemia transitoria asintomática puede no ser infrecuente.
Resultados estériles son improbables en neonatos que están bacterémicos con un organismo para el que los cultivos están diseñados para detectar si los cultivos están correctamente obtenidos.
Sin embargo, algunos bebés con infecciones bacterianas graves, tales como neumonía, no son bacteriémicos y tienen hemocultivos estériles; el contenido y la duración del tratamiento con antibióticos en tales casos se deja a criterio clínico.
Cultivo de LCR
Como la incidencia de EOS ha disminuido en las últimas 2 décadas, también lo ha hecho la proporción de neonatos con EOS que tienen meningitis, lo que hace que los criterios para obtener cultivos de LCR sean más difíciles de definir y más controvertidos.
Aunque el uso selectivo de la punción lumbar puede haber conducido a una subestimación de los casos de meningitis, solo 4% de bebés de todas las edades gestacionales con EOS en una cohorte de vigilancia de los CDC de 2005 a 2014 y 3% de cohorte de la Red de Investigación Neonatal del NICHD de 2015 a 2017 fueron diagnosticado con meningitis.
El fundamento del cultivo de LCR como parte de la evaluación de rutina de la EOS se basa en la observación de que una parte de los recién nacidos con meningitis bacteriana confirmada por cultivo no tienen un resultado positivo de los hemocultivos, pero la incidencia de todos los organismos entre todos los recién nacidos es muy baja (1 -2 por 100.000 nv) .
Entre los casos de EOS de GBS que ocurren en recién nacidos a término, la vigilancia nacional de 2006 a 2015 encontró GBS aislado del LCR solo en aproximadamente 2 casos por 1.000.000 de nv.
En datos de una era anterior, no se identificaron casos de meningitis entre 284 neonatos asintomáticos que se sometieron a punción lumbar debido a factores de riesgo maternos.51 La proporción de neonatos a término que son tratados por sospecha de EOS en estudios contemporáneos y que se encuentran bacteriémicos es en la actualidad menos del 1% .33,44 En la mayoría de los casos, por lo tanto, y definitivamente entre los recién nacidos a término con buen aspecto, la punción lumbar se puede derivar hasta que el hemocultivo arroje un patógeno. La punción lumbar está indicada si otros hallazgos (ejemplo, convulsiones) apuntan específicamente a una enfermedad del sistema nervioso central. Aunque aplazar el cultivo de LCR puede comprometer las oportunidades de aislamiento de patógenos, el análisis de fluidos puede ser útil para optimizar el contenido y la duración del tratamiento con antibióticos.
En la rara circunstancia de meningitis sin bacteriemia, el análisis del LCR mediante un panel de PCR multiplex puede permitir la identificación de un organismo causante hasta varios días después del inicio del tratamiento52. La selección de neonatos en riesgo para punción lumbar basada en elevación de niveles de proteína C reactiva sérica (PCR) no está respaldada por datos empíricos, que muestran un desempeño deficiente de la PCR en la identificación de casos de meningitis definitiva o probable entre los neonatos enfermos evaluados por sepsis53.
Amplificación de ácido nucleico
Las metodologías que utilizan amplificación de ácidos nucleicos para identificar y caracterizar rápidamente el ADN bacteriano en sangre u otros fluidos tisulares están empezando a estar disponibles para el uso clínico.
Estos métodos pueden proporcionar una identificación de patógenos más rápida a partir de resultados positivos de hemocultivos en comparación con las técnicas tradicionales de microbiología.
Estos métodos también pueden ser potencialmente más sensibles que los hemocultivos y pueden producir resultados en neonatos con bacteriemia de densidad ultra baja o después de la exposición a antibióticos.
Estas posibilidades no se han confirmado en estudios prospectivos que abordan la sensibilidad y la especificidad en comparación con los diagnósticos basados en cultivos.
Los resultados falsos positivos, en los que se detecta ADN bacteriano en ausencia de organismos circulantes viables, son problemáticos para el diagnóstico y el tratamiento de EOS.
Será necesaria experiencia adicional con estos métodos antes de que se adopten en la práctica habitual.
Recuento de leucocitos, proteína C-Reactiva, Procalcitonina
y otros tests
Pruebas de diagnóstico complementarias, que incluyen recuentos hematológicos, reactantes de fase aguda y una variedad de citocinas o quimiocinas, se han evaluado como posibles indicadores de sepsis neonatal.
Virtualmente todos tienen una sensibilidad muy baja al inicio de la infección o poco después y la mayoría son bastante inespecíficos en el período neonatal inmediato.
Como tal, estas pruebas de laboratorio no tienen utilidad para tomar decisiones sobre el inicio o la suspensión de la terapia con antibióticos en bebés con riesgo de EOS.
Durante muchos años, se han utilizado varios componentes del recuento sanguíneo completo y del diferencial en la evaluación de neonatos con riesgo de EOS.
Los recuentos de glóbulos blancos con valores extremos (recuento total de glóbulos blancos < 5000 / ml o < 1000 / ml, recuento absoluto de neutrófilos < 1000 / ml o < 2.000 / ml, ratios neutrófilos inmaduros: neutrófilos totales > 0.3 o > 0.5) se asociaron con razones de probabilidad positivas altas pero con una sensibilidad muy baja.
Debido a la baja incidencia de EOS, incluso los índices de mejor desempeño tienen un valor predictivo positivo bajo y un valor predictivo negativo alto y proporcionan muy poca información de diagnóstico.
Por lo tanto, los valores hematológicos no son suficientes ni para respaldar la decisión de aplazar el tratamiento en un neonato que presenta signos clínicos de enfermedad ni para iniciar el tratamiento en uno que no los tenga.
Los recuentos seriados de células sanguíneas normales se han asociado con bajas probabilidades de EOS , pero no se suman de manera apreciable a los resultados del cultivo como guías para el manejo.
Las mediciones seriadas de los reactantes de fase aguda pueden correlacionarse con los resultados de los cultivos estériles.
Análisis post hoc reciente de datos de cohorte del Estudio de Procalcitonina neonatal (NeoPIns) encontró que mediciones seriadas de PCR o procalcitonina (PCT) durante las primeras 36 horas después del nacimiento, con umbrales de corte de 16 mg / L y 2,8 ng / L, respectivamente , tuvieron valores predictivos negativos del 100% para distinguir ausencia de sepsis de infección confirmada por cultivo.
Investigadores concluyeron que niveles normales seriados de estos marcadores a las 36 horas de edad brindaban suficiente tranquilidad para detener la terapia con antibióticos.
No está claro por qué son necesarios los reactivos de fase aguda seriados que se correlacionan con los resultados de los hemocultivos estériles, aunque aquellos con preocupación por la sepsis "con cultivo negativo" pueden encontrar tranquilizadores los resultados de estas pruebas.
Estas pruebas tienen un valor predictivo positivo muy bajo para la bacteriemia confirmada por cultivo (< 1% para PCR ≥ 10 mg / L a las 18 horas de edad en neonatos ≥ 35 semanas de gestación61; no se dispone de datos fiables para niveles de PCT en RN a término con sepsis confirmada) .
No hay datos para informar la utilidad de continuar con los antibióticos cuando los valores de la prueba no se correlacionan con los resultados del cultivo obtenidos correctamente.
Por lo tanto, los niveles elevados no justifican la continuación de la terapia con antibióticos ante los resultados de cultivos estériles.
Tratamiento empírico y definitivo
Tratamiento empírico
El tratamiento empírico de la EOS sospechada se dirige a los 2 patógenos predominantes, GBS y E. coli.
Dados los datos de susceptibilidad revisados anteriormente, la combinación de ampicilina y gentamicina sigue siendo el tratamiento empírico preferido actualmente.
Esta combinación también proporcionará cobertura para los organismos menos comunes que causan EOS, incluyendo los estreptococos viridans, enterococos, Listeria monocytogenes y muchos organismos gramnegativos entéricos.
El uso de cefalosporinas de tercera generación, que serán eficaces para la mayoría de las cepas resistentes de E. coli pero no para Enterococcus o Listeria, se ha asociado con un aumento de la mortalidad.
Organismos productores de b-lactamasa de espectro extendido raramente causan EOS en neonatos a término en Estados Unidos , por lo que no está indicado el uso rutinario de agentes como los carbapenémicos.
Sin embargo, dados los datos revisados anteriormente con respecto a E. coli con resistencia tanto a la ampicilina como a la gentamicina, la adición de un antimicrobiano de espectro más amplio debe reservarse para los recién nacidos a término que están críticamente enfermos o que responden mal al tratamiento mientras los cultivos están pendientes o para quienes el cultivo preliminar los resultados identifican bacilos gramnegativos.
Tratamiento definitivo
El tratamiento definitivo de la EOS depende del aislamiento del patógeno en cultivo y la determinación de la susceptibilidad a los antibióticos e idealmente consiste en el antibiótico de espectro más estrecho apropiado para la situación clínica.
Otras consideraciones para la terapia definitiva incluyen la presencia o ausencia de meningitis, así como cualquier evidencia de disfunción renal o hepática.
La sepsis o meningitis por GBS se puede tratar con ampicilina o penicilina;
Las recomendaciones de dosificación se incluyen en la guía actualizada de GBS. 20
Para la sepsis causada por E. coli sensible a la ampicilina, la ampicilina es suficiente;
Los datos de susceptibilidad deben orientar la elección de cepas resistentes a la ampicilina.
Si se sospecha o se confirma una meningitis por gram negativos , se prefiere una cefalosporina o un carbapenem, que proporcionen una penetración superior en el sistema nervioso central.
Resumen
Dado que es ahora una enfermedad rara, se han desarrollado nuevas estrategias para reducir las pruebas de diagnóstico y el tratamiento empírico.
La adopción y el perfeccionamiento de estas estrategias debe ser una prioridad para todas las instalaciones donde nacen los bebés.
Puntos de cuidado clínico
La EOS ocurre en aproximadamente 1 de cada 2000 recién nacidos a término
Los organismos más comunes aislados en los casos de EOS entre los recién nacidos a término son GBS y E. coli
Los recién nacidos a término pueden ser evaluados para EOS utilizando algoritmos categóricos, modelos de riesgo multivariables o enfoques basados principalmente en exámenes clínicos seriados.
La ampicilina y la gentamicina siguen siendo la combinación de antibióticos empíricos más apropiada para los recién nacidos a término con riesgo de EOS.
Se puede considerar la adición de antibióticos de espectro más amplio para los recién nacidos a término con mayor riesgo, particularmente aquellos con enfermedades críticas.
Mejores prácticas
¿ Cuál es la práctica actual para identificar y tratar a los recién nacidos a término en riesgo de sepsis neonatal de inicio temprano ?
Mejores prácticas y guías :
Prácticas obstétricas actuales para prevención de la sepsis neonatal de inicio temprano son eficaces y deben continuarse.
Reconocimiento de baja incidencia actual de sepsis de inicio temprano en recién nacidos a término, incluyendo aquellos con factores de riesgo como exposición a corioamnionitis, ha requerido reevaluación de estrategias para determinación y tratamiento de infecciones bacterianas graves en recién nacidos a término.
Academia Estadounidense de Pediatría15,20 ha proporcionado guías para el manejo de neonatos con riesgo de sepsis neonatal de aparición temprana y las han respaldado los Centros para el Control y la Prevención de Enfermedades.
Principales recomendaciones
En todos los centros se deben adoptar estrategias sistemáticas para reducir las pruebas de diagnóstico innecesarias, administración empírica de antibióticos e interrupción del vínculo madre-hijo, mientras se mantiene un alto nivel de vigilancia de la sepsis neonatal.
Independientemente del enfoque que se adopte para la evaluación inicial para la determinación de los bebés con sepsis, es necesaria una observación cuidadosa y continua de todos los bebés durante las primeras 24 a 48 horas para garantizar el reconocimiento de bebés que se enferman por cualquier causa dentro de ese período de tiempo.
Ampicilina y gentamicina siguen siendo antibióticos preferidos para tratamiento empírico de neonatos que cumplen los criterios de umbral.
Terapia con antibióticos debe centrarse en utilizar el agente de espectro más estrecho al que sea susceptible el cultivo aislado, o interrumpirse después de 36 horas si los hemocultivos son estériles (en ausencia de evidencia de una infección bacteriana grave focal)
Declaración resumida
La reevaluación de la epidemiología actual de la sepsis neonatal de aparición temprana ha generado la revisión de las guías para el tratamiento de los recién nacidos potencialmente en riesgo.
Estos cambios han sido particularmente sustanciales para los recién nacidos a término.
La adopción de estrategias para limitar las pruebas de diagnóstico y el uso de antibióticos en esta población, así como los esfuerzos continuos para mejorar esas estrategias, es esencial.