
Sepsis Neonatal
Enero 2014
I.- Epidemiología de Sepsis Neonatal
1.- ¿ Cómo se define sepsis de inicio precoz ?
Sepsis de inicio precoz comienza a los 3 días de edad (ó incluso antes) cuando los organismos ascienden desde el canal de parto después de la ruptura abierta u oculta de las membranas.
La sepsis de inicio precoz por lo general se manifiesta como enfermedad sistémica fulminante y se asocia con tasas de mortalidad de 3% a 50% (más alta en neonatos prematuros). La infección por patógenos gram-negativos y los neonatos de bajo peso al nacer tienen mayor riesgo de mortalidad.
Randis TM, Polin RA. Early-onset group B Streptococcal sepsis: new recommendations from the Centres for Disease Control and Prevention. Arch Dis Child Fetal Neonatal Ed. 2012;97(4):F291–4.
Polin RA, Committee on Fetus and Newborn. Management of neonates with suspected or proven early-onset bacterial
sepsis. Pediatrics 2012;129(5):1006–15.
2.- ¿ Cómo el uso de antibióticos maternos intraparto ha alterado la incidencia de sepsis neonatal de inicio precoz ?
Desde que se desarrollaron las guías de consenso en 1996 y posteriormente revisadas en 2002 y 2010, la incidencia de las infecciones de inicio precoz por Streptococcus agalactiae (SGB) ha disminuído desde 1,7 por 1000 nacidos vivos a 0,28 por 1000 nacidos vivos, una reducción del 70% en la incidencia de sepsis de inicio precoz por EGB.
Durante el mismo período, sin embargo, la administración de antibióticos intraparto se ha asociado con una mayor incidencia de sepsis neonatal resistente a medicamentos, especialmente enfermedad por gram negativos resistentes a ampicilina en neonatos de muy bajo peso al nacer (MBPN) (<1500 g). Si el aumento de sepsis por gram-negativos se debe a la profilaxis antibiótica intraparto sigue siendo controversial.
Eberly MD, Rajnik M. The effect of universal maternal screening on the incidence of neonatal early-onset group B streptococcal
disease. Clin Pediatr (Phila) 2009;48(4):369–75.
Sakata H. Evaluation of intrapartum antibiotic prophylaxis for the prevention of early-onset group B streptococcal infection.
J Infect Chemother 2012;18(6):853–857.
3.- ¿ Cómo ha cambiado la epidemiología de la sepsis de inicio precoz en los neonatos de muy bajo peso de nacimiento (MBPN) (<1500 g) ?
Entre los
neonatos de MBPN la incidencia de sepsis de
inicio precoz aumenta al disminuir la edad gestacional
(15 casos
por
1.000
nacidos vivos para prematuros en comparación con 2,5 casos
por
1.000
nacidos vivos para recién nacidos a término).
En comparación con los datos obtenidos antes de la creación de
guías para la prevención de la enfermedad por EGB, se
ha producido una reducción significativa de la enfermedad por EGB de inicio
precoz,
desde
5,9 a
1,7 casos por cada 1.000 nacidos vivos, con un
incremento concomitante
de la sepsis por
E. coli
desde
3.2 a 6,8 por cada 1.000 nacidos vivos.
Aproximadamente el 85% de los
aislados de E. coli han sido resistentes a la
ampicilina. Cuando
se comparan los períodos
1991
-
1993
con
1998
-
2000, también hubo un aumento en la incidencia de
enfermedad fúngica de inicio precoz
, desde
0,1 a 0,4 por 1.000
nacidos vivos.
Randis TM, Polin RA. Early-onset group B Streptococcal sepsis: new recommendations from the Centres for Disease Control and Prevention. Arch Dis Child Fetal Neonatal Ed 2012;97(4):F291–4.
Stoll BJ, Hansen N, Fanaroff AA, et al. Changes in pathogens causing early-onset sepsis in very-low-birth-weight infants. N Engl J Med 2002;347(4):240–7.
4.- ¿ Cuáles son los principales factores de riesgo para corioamnionitis materna ?
Baja paridad, trabajo de parto espontáneo, duración más larga del trabajo de parto y rotura de membranas, múltiples exámenes digitales, líquido amniótico teñido de meconio, monitoreo uterino ó fetal interno y presencia de infecciones del tracto genital. La incidencia de corioamnionitis está inversamente relacionada con la edad gestacional.
Schuchat A, Zywicki SS, Dinsmoor MJ, et al. Risk factors and opportunities for prevention of early-onset neonatal sepsis: a multicenter case-control study. Pediatrics 2000;105(1 Pt 1):21–6.
5.- ¿ Cuáles factores maternos y neonatales aumentan el riesgo de enfermedad de inicio precoz ?
Los principales factores de riesgo para sepsis neonatal de inicio precoz son el nacimiento prematuro (el factor más estrechamente asociado con sepsis neonatal de inicio precoz), la colonización materna con EGB, ruptura prolongada de membranas (> 18 horas antes del trabajo de parto) y signos y síntomas de corioamnionitis.
Otras variables
incluyen el
origen étnico (por ejemplo, mujeres afroamericanas tienen tasas más altas de
colonización por EGB),
el
bajo nivel socioeconómico,
sexo masculino
y
scores de Apgar bajos.
El
peso al
nacer se relaciona inversamente con el riesgo de sepsis de
inicio precoz. (Tabla 13-2).

La presencia de cualquiera de estos factores por sí solo no es una indicación para estudio completo de sepsis ni de terapia antibiótica; sin embargo las combinaciones de factores de riesgo son claramente acumulativas y deben dar lugar a sospecha de sepsis.
Hyde TB, Hilger TM, Reingold A, et al. Trends in incidence and antimicrobial resistance of early-onset sepsis: population
6.- ¿ Cuál es la tasa de ataque para sepsis neonatal en presencia de factores de riesgo antes mencionados ?
Como regla general, la presencia de un factor de riesgo importante (por ejemplo, ruptura prematura de membranas fetales ó colonización materna por EGB ) causa una tasa de ataque de alrededor de 1% para sepsis probada ó 2% para la sepsis probada ó altamente sospechosa.
Si un segundo factor de riesgo está presente, la tasa de ataque se eleva al 4 - 6 % para sepsis probada y 10% para sepsis comprobada o sospechada. Factores de riesgo adicionales son aditivos; la presencia de tres factores de riesgo aumenta el riesgo de sepsis 25 veces sobre la línea base.
7.- ¿ Cuál es la distribución de patógenos entre neonatos a término y prematuros con sepsis ?
La patogenia de la sepsis de inicio precoz ha cambiado en las últimas décadas dado que protocolos de profilaxis antibiótica intraparto han llegado a utilizarse ampliamente. El EGB (estreptococo grupo B) y bacilos entéricos gramnegativos, predominantemente E. coli, son los patógenos más comunes para enfermedad de inicio precoz. En los recién nacidos prematuros que pesan menos de 1.500 gramos, E. coli es más común que el EGB .
Estafilococos coagulasa negativos (ECN ó CoNS); Staphylococcus aureus; Enterococcus, Klebsiella y Enterobacter spp, Pseudomonas aeruginosa y hongos (especialmente Candida albicans) son los principales agentes patógenos para las enfermedades de inicio tardío (inicio después de las 72 horas)
Remington JS, Klein JO, Wilson CB, et al. Infectious diseases of the fetus and newborn: expert consult—online and print. 7th ed. Philadelphia: Saunders; 2010.
Stoll BJ, Hansen N, Fanaroff AA, et al. Changes in pathogens causing early-onset sepsis in very-low-birth-weight infants. N Engl J Med 2002;347(4):240–7.
Lin F-YC, Weisman LE, Troendle J, et al. Prematurity is the major risk factor for late-onset group B streptococcus disease. J Infect Dis 2003;188(2):267–71.
8.- ¿ Porqué la infección con CoNS ha llegado a ser un patógeno común en la UCIN ?
CoNS (Estafilococo coagulasa negantivo) ha aumentado como patógeno en la UCIN dado que la sobrevida de neonatos de extremo bajo peso de nacimiento (<1000 grams) ha aumentado. La bacteremia por CoNS
se asocia con líneas vasculares colocadas (catéteres) . El CoNS produce un biofilm que facilita la adherencia al catéter y lo protege de antibióticos y de las respuestas inmunes de los huéspedes.Healy CM, Baker CJ, Palazzi DL, et al. Distinguishing true coagulase-negative Staphylococcus infections from contaminants in the neonatal intensive care unit. J Perinatol 2013;33(1):52–58.
9.- ¿ Cuáles son las diferencias clínicas entre sepsis por EGB de inicio precoz y sepsis de inicio tardío ó muy tardío ?
Las manifestaciones clínicas de sepsis neonatal por EGB de inicio tardío son más insidiosas y la meningitis es con frecuencia parte del cuadro clínico. La enfermedad de inicio tardío se asocia con EGB serotipo III y tiene una tasa de mortalidad más baja que la sepsis precoz. Con el aumento de la sobrevida de los recién nacidos con extremo bajo peso al nacer, la enfermedad de inicio muy tardío (> 98 días) también se ha descrito (tabla 13-3)
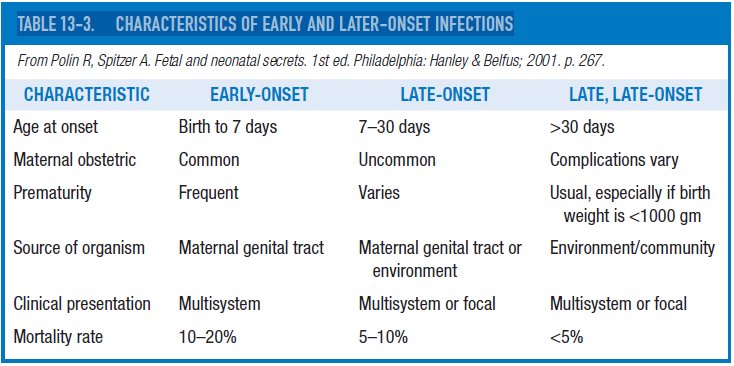
10.- ¿ Cuáles son las consecuencias adversas de las infecciones de inicio tardío entre los neonatos de muy bajo peso de nacimiento ?
Ductus arteriosus persistente
Necesidad prolongada de ventilación mecánica
Duración prolongada de nutrición parenteral total y necesidad de catéteres colocados.
Enterocolitis necrotizante
Estadía hospitalaria prolongada
Costo aumentado del cuidado
Riesgo aumentado de muerte
Wynn JL, Wong HR. Pathophysiology and treatment of septic shock in neonates. Clin Perinatol 2010;37(2):439–79.
11.- ¿ Cuáles son los mayores factores de riesgo para sepsis neonatal de inicio tardío ?
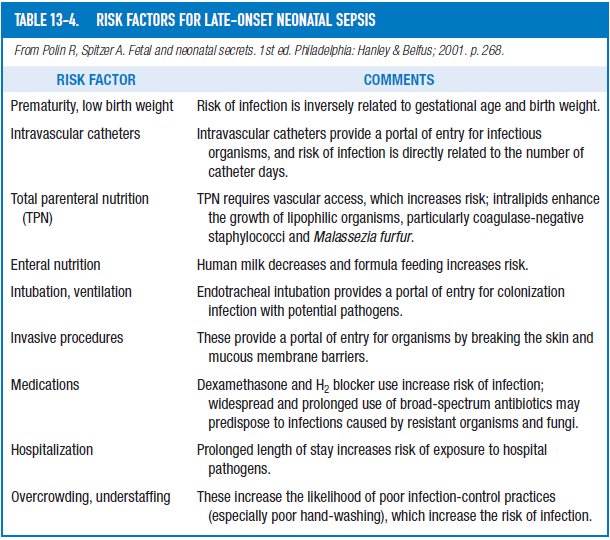
II.- Diagnóstico de sepsis neonatal
1.- ¿ Cuan sensible es el diagnóstico clínico de corioamnionitis?
El criterio más sensible para el diagnóstico clínico de corioamnionitis es fiebre materna mayor a 38 ° C. La presencia de dos o más de los siguientes criterios también apoya el diagnóstico :
Leucocitosis materna (> 15.000 células/mm3)
Taquicardia materna (> 100 lpm)
Taquicardia fetal (> 160 lpm)
Dolor uterino
Mal olor del líquido amniótico
Si están presentes fiebre materna y dos o más de los criterios mencionados, existe un riesgo significativo para sepsis neonatal, con tasas de ataque reportadas que van desde 6% a 20%. Este tópico se complica adicionalmente por el uso de anestesia epidural, la cual se asocia con aumento en la incidencia cuatro veces mayor de fiebre materna sin aumentar la tasa de sepsis neonatal.
Polin RA, Committee on Fetus and Newborn. Management of neonates with suspected or proven early-onset bacterial sepsis. Pediatrics 2012;129(5):1006–15.
2.- ¿ Cuáles son los signós y síntomas de presentación de sepsis neonatal ?
El diagnóstico clínico de sepsis neonatal es difícil porque muchos de los signos son inespecíficos. Incluyen fiebre, dificultad respiratoria, ictericia, letargo, irritabilidad, anorexia o vómitos, hipotonía, "no se ve bien", distensión abdominal, hipotermia, hipoglucemia, apnea, convulsiones, shock, petequias y púrpura. Hay una considerable superposición con condiciones no infecciosas y algunos neonatos pueden presentar signos clínicos anormales transitoriamente durante la transición a la vida postnatal
3.- ¿ Los neonatos con sepsis siempre están febriles ?
La temperatura de un recién nacido con sepsis puede ser elevada; disminuída ó como se observa con frecuencia, dentro de límites normales. Los recién nacidos a término tienen mayor probabilidad de tener fiebre que los prematuros, mientras que estos últimos son más propensos a presentar hipotermia. La fiebre es generalmente considerada como una temperatura rectal mayor a 38 ° C . La fiebre también puede ser debida a muchas otras causas no infecciosas, tales como elevación de la temperatura ambiental.
4.- ¿ Cómo pueden ayudar los datos de laboratorio en el diagnóstico de sepsis neonatal ?
Los tests diagnósticos pueden ayudar con la decisión de interrumpir el tratamiento. El aislamiento de un microorganismo desde un sitio estéril, tal como sangre o líquido cefalorraquídeo (LCR) sigue siendo el método más válido de diagnóstico de sepsis bacteriana.
Jordan JA. Molecular diagnosis of neonatal sepsis. Clin Perinatol 2010;37(2):411–9.
Escobar GJ, Li DK, Armstrong MA, et al. Neonatal sepsis workups in infants >/=2000 grams at birth: a population-based study. Pediatrics 2000;106(2 Pt 1):256–63.
5.- ¿ Son las superficies corporales útiles para establecer el diagnóstico de sepsis ?
Los cultivos de superficie corporal tienen una sensibilidad, especificidad y valor predictivos muy limitados y no establecen infección sistémica invasiva. Ellos revelan sólo colonización y están poco correlacionados con patógenos aislados desde sangre.
6.- ¿ Cuán confiable es el Hemocultivo en el diagnóstico de sepsis neonatal ?
En estudios de recién nacidos que fallecieron , el diagnóstico postmortem de sepsis fue confirmado por hemocultivos antemortem en sólo el 80% de los casos. El amplio uso actual de antibióticos maternos confunde aún más la confiabilidad del hemocultivo neonatal.
Remington JS, Klein JO, Wilson CB, et al. Infectious diseases of the fetus and newborn: expert consult—online and print. 7th ed.Philadelphia: Saunders; 2010.
7.- ¿ Cuánto volumen de sangre debe extraerse en hemocultivo neonatal ?
Un mínimo de 1 ml de sangre debe extraerse para establecer el diagnóstico de bacteriemia cuando se utiliza un solo frasco de hemocultivo pediátrico. La división de la muestra por la mitad y la inoculación de frascos aeróbicos y anaeróbicos es probable que reduzca la sensibilidad (0,5 ml de sangre no detectará confiablemente 4 unidades formadoras de colonias / ml) y no se recomienda.
8.- ¿ Debe un urocultivo ser parte del estudio para sepsis en el neonato ?
En la sepsis de inicio precoz , los urocultivos positivos son atribuíbles a la siembra de los riñones durante un episodio de bacteriemia a diferencia de las infecciones del tracto urinario (ITU) en lactantes de más edad, que suelen ser infecciones ascendentes. Por lo tanto los urocultivos dan información muy limitada sobre la fuente de infección en sepsis precoz y no deberían ser parte del estudio de sepsis. Sin embargo, la aspiración suprapúbica ó cateterismo vesical deben realizarse en todos los recién nacidos con sospecha de sepsis de inicio precoz.
Polin RA, Committee on Fetus and Newborn. Management of neonates with suspected or proven early-onset bacterial sepsis. Pediatrics 2012;129(5):1006–15.
Stoll BJ, Hansen N, Fanaroff AA, et al. Changes in pathogens causing early-onset sepsis in very-low-birth-weight infants. N Engl J Med 2002;347(4):240–7.
Lieberman E, Lang J, Richardson DK, et al. Intrapartum maternal fever and neonatal outcome. Pediatrics 2000;105(1 Pt 1):8–13.
Puntos Claves : Diagnóstico de infección neonatal
La sensibilidad de los hemocultivos aumenta con el aumento de volumen.
No hay una prueba de laboratorio única ó combinación de pruebas que sea 100% sensible ó específica para diagnóstico de infección.
9.- ¿ Cuándo debe realizarse una punción lumbar ?
La decisión de realizar una punción lumbar en recién nacidos con sospecha de sepsis de inicio precoz sigue siendo controvertida. Los niños con signos clínicos que pueden atribuirse a condiciones no infecciosas tales como sindrome de dificultad respiratoria tienen una muy baja probabilidad de meningitis. Sin embargo , hasta un 23 % de los niños con bacteriemia tienen meningitis concomitante y a menudo no presentan signos clínicos atribuíbles directamente al sistema nervioso central ( SNC). Además, hasta un 38 % de neonatos con meningitis tienen un hemocultivo negativo. Por lo tanto, la presencia de un hemocultivo positivo no puede servir como indicación para hacer una punción lumbar.
Debido a que la meningitis neonatal es una enfermedad de baja incidencia ( 0,25 por 1.000 nacidos vivos) , un meta- análisis informal de los reportes publicados demostró que sería necesario hacer al menos 1.000 punciones lumbares para diagnosticar un caso que fuese errado por la falta de síntomas ó resultado negativo de hemocultivo.
Un enfoque racional sería realizar punción lumbar en niños con hemocultivos positivos , en aquellos que se deterioran a pesar de tratamiento antimicrobiano y en aquellos cuya clínica ó datos de laboratorio sugieren fuertemente sepsis bacteriana si no tienen ninguna contraindicación para el procedimiento.
10.- ¿ Podemos interpretar el contenido de células y la química del LCR neonatal con los mismos paaámetros usados en niños de más edad ?
El contenido celular y la química del LCR neonatal difieren del de los niños de más edad. El contenido celular del LCR sobre todo en la primera semana de vida es más alto y a menudo están presentes leucocitos polimorfonucleares en el LCR de recién nacidos normales. En un estudio reciente, el límite superior de referencia de recuento de leucocitos en el LCR fué 12 células/mm3 en recién nacidos prematuros y 14 células/mm3 en recién nacidos a término . La mayoría de neonatos sanos tendrán recuentos de células inferiores a 10 células/mm3.
El ajuste del recuento de células para el número de glóbulos rojos no mejora su utilidad diagnóstica .
Los recién nacidos prematuros tienen concentraciones de proteína que se correlacionan inversamente con su edad gestacional. Los neonatos a término no infectados tienen concentraciones de proteína en LCR menores a 100 mg / dl, con disminución fisiológica con la edad postnatal alcanzando valores de lactantes de mayor edad sanos antes del tercer mes de vida.
Las concentraciones de glucosa en LCR en neonatos no infectados normoglucémicos son similares a las de lactantes de más edad ( 70 a 80 % de glicemia periférica simultánea ) . Puede haber meningitis neonatal con valores en LCR completamente normales.
Srinivasan L, Shah SS, Padula MA, et al. Cerebrospinal fluid reference ranges in term and preterm infants in the neonatal intensive care unit. J Pediatr 2012;161(4):729–34.
11.- ¿ Cómo puede ayudar un recuento de leucocitos en el diagnóstico de sepsis de inicio precoz ?
Recuentos leucocitarios elevados ó índices anormales de neutrófilos (recuento absoluto de neutrófilos bajo [neutropenia], conteo de baciliformes aumentado y relación neutrófilos inmaduros a totales [I / T] alta ) tienen un valor predictivo positivo pobre para el diagnóstico de sepsis de inicio precoz. Son útiles para excluir a niños sin infecciones más bien que para identificar a los infectados. La neutropenia es el índice con la mejor especificidad.
La definición de neutropenia varía con la edad, tipo de parto, sitio de muestra y altitud, los valores máximos se alcanzan entre 6 y 8 horas después del parto. Un estudio reciente sugiere que los límites más bajos de glóbulos blancos normales en ese momento deben ser 7.500 / mm3 para neonatos nacidos con más de 36 semanas de gestación, 3500 / mm3 para aquellos entre 28 y 36 semanas y 1.500 / mm3 para los menores de 28 semanas de gestación.
12.- ¿ Cuál es la relevancia de la PCR en el diagnóstico de sepsis neonatal ?
La sensibilidad de la PCR al nacer es baja, debido a que requiere una respuesta inflamatoria para aumentar (con la liberación de IL-6). Su sensibilidad mejora dramáticamente si la determinación se realiza 6 a 12 horas después. Dos determinaciones de PCR normales (8 a 24 horas después del nacimiento y 24 horas más tarde) tienen una precisión predictiva negativa de 99,7% para sepsis neonatal comprobada.
13.- ¿ Son útiles las determinaciones de citoquinas en el diagnóstico de sepsis neonatal de inicio precoz ?
Varios mediadores inflamatorios han sido investigados como posibles pruebas de diagnóstico para sepsis neonatal. Se ha encontrado que IL-6, IL-8 e IL-10 tienen un rol crítico en la respuesta inflamatoria durante la sepsis neonatal, sin embargo, ninguno de estos mediadores tiene sensibilidad ó especificidad suficiente para el diagnóstico de infección en esta población. Estos mediadores no están actualmente disponibles para uso clínico de rutina.
Venkatesh M, Flores A, Luna RA, et al. Molecular microbiological methods in the diagnosis of neonatal sepsis. Expert Rev Anti Infect Ther 2010 Sep;8(9):1037–48.
III.- Tratamiento antibiótico
1.- ¿ Cuál es el tratamiento inicial recomendado para sepsis de inicio precoz ?
Una vez que se sospecha sepsis en un recién nacido, el tratamiento antimicrobiano debe comenzar de inmediato una vez que se han obtenido los cultivos, incluso cuando no existen factores de riesgo obvios para sepsis. Debido a que EGB y E. coli son los patógenos más comunes de la sepsis de inicio precoz en Estados Unidos, una combinación sinérgica de ampicilina y un aminoglucósido (por lo general gentamicina) es adecuada para el tratamiento inicial de sepsis de inicio precoz. La ampicilina es el antimicrobiano de elección para el tratamiento de EGB (estreptococo grupo B) , Listeria monocytogenes y mayoría de los enterococos. Una vez que el agente patógeno se identifica, la terapia antimicrobiana debería acotarse (a menos que se requiera sinergismo)
Muller-Pebody B, Johnson AP, Heath PT, et al. Empirical treatment of neonatal sepsis: are the current guidelines adequate? Arch Dis Child Fetal Neonatal Ed 2011;96(1):F4–8.
2.- ¿ Es la cefotaxima una alternativa aceptable a gentamicina ?
Las cefalosporinas de tercera generación, tales como cefotaxima están asociadas con el rápido desarrollo de bacterias resistentes a antibióticos en las Unidades de neonatología y su uso extensivo se ha reportado que es un factor de riesgo para candidiasis invasiva. Además, las cefalosporinas de tercera generación no son activas frente a especies de Listeria y Enterococcus. Debido a su excelente penetración en el LCR, el uso de cefotaxima debe restringirse para neonatos con meningitis atribuíble a organismos gram-negativos
Hyde TB, Hilger TM, Reingold A, et al. Trends in incidence and antimicrobial resistance of early-onset sepsis: population-based surveillance in San Francisco and Atlanta. Pediatrics 2002;110(4):690–5.
3.- ¿ Porqué la Ceftriaxona no debe ser usada en neonatos?
La ceftriaxona puede desplazar la bilirrubina de la albúmina y puede aumentar el riesgo de kernicterus en un neonato con ictericia
.
4.- ¿ Debe suspenderse el tratamiento antibiótico si los cultivos permanecen negativos después de 48 horas?
Suspender el tratamiento para bacteriemia sin foco identificable de infección sigue siendo controvertido y la decisión final requiere la consideración del uso de antibióticos durante el trabajo de parto y de la evolución clínica del niño. Tres estudios observacionales recientes han demostrado una asociación entre el uso de antibióticos durante más de 5 días en recién nacidos con sospecha de sepsis de inicio precoz (y hemocultivos negativos) con muerte y enterocolitis necrotizante. Por lo tanto, en un neonato que se "ve bien" los antibióticos no deben ser continuados durante más de 48 horas (72 horas en algunos casos)
5.- ¿ Hau algún rol para la terapia adjunta con Ig endovenosa en sepsis neonatal ?
Un reciente estudio deble ciego, controlado, de terapia adjunta con Ig (inmunoglobulina ) endovenosa no mostró efecto sobre los outcomes (muerte y discapacidad mayor a los 2 años) de sepsis neonatal sospechada ó probada.
INIS Collaborative Group, Brocklehurst P, Farrell B, et al. Treatment of neonatal sepsis with intravenous immune globulin. N Engl J Med 2011;365(13):1201–11.
6.- ¿ Cuál es a terapia empírica aceptable para sepsis de inicio tardío ?
Debido a que el
Staphylococcus epidermidis es la causa más común de sepsis nosocomial en neonatos, la terapia empírica debe incluir vancomicina. Este antibiótico es generalmente pareado con un antibiótico aminoglicósido para cubrir organismos gram negativos.
7.- ¿ Cuáles son las reaación adversas principales a antibióticos usados comúnmente en neonatos?
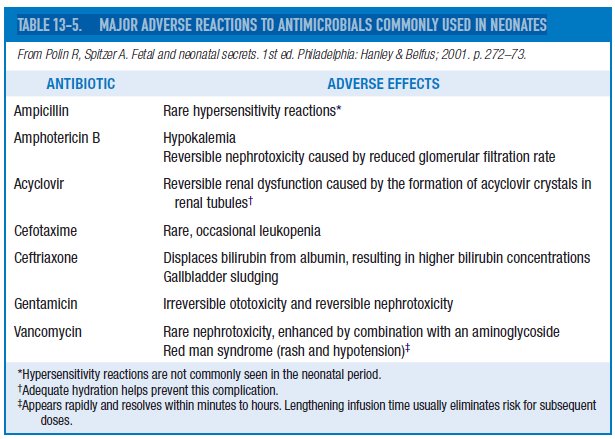
8.- ¿ Los gemelos , tienen riesgo de sepsis si uno de ellos está infectado ?
Algunos estudios han demostrado un mayor riesgo de contraer una infección ascendente intrauterina en el primer gemelo nacido, pero este riesgo es modificado por el modo de parto y otras variables obstétricas. Más interesante es la observación de ocurrencia simultánea de sepsis de inicio tardío entre gemelos, lo que indica una estrecha observación y consideración de cultivos en el gemelo asintomático.
IV.- Meningitis neonatal
1.- ¿ Cuáles son los mecanismos de daño cerebral en meningitis ?
Infartos vasculares (vasoespasmo / trombosis)
Especies reactivas del oxígeno
Aminoácidos excitotóxicos.
Alteraciones en el flujo sanguíneo cerebral.
2.- ¿ Qué factores influencian las concentraciones de antibióticos en LCR ?
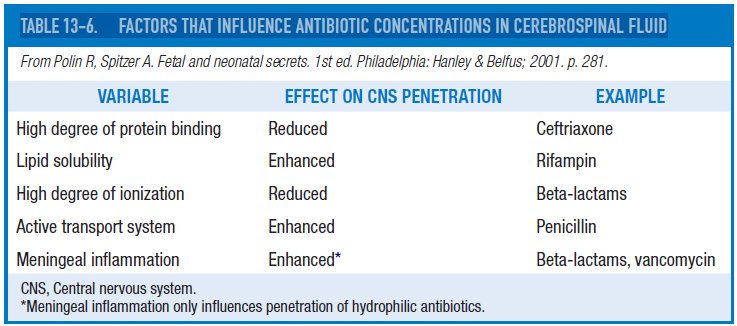
3.- ¿ Cuáles son las recomendaciones para terapia empírica inicial de meningitis en el neonato ?
Se recomienda un esquema de ampicilina y cefotaxima para la terapia empírica inicial. El tratamiento debe ser modificado de acuerdo a los resultados de microbiología. Meropenem ó ceftazidima deben reservarse para las infecciones causadas por microorganismos resistentes.
4.- ¿ Cómo debe ser tratada la meningitis por gram-positivos y gram-negativos durante el período neonatal ?
Tratamiento de meningitis causada por microorganismos entéricos : se prefiere cefotaxima y a menudo se combina con un aminoglucósido. La meningitis por gramnegativos generalmente se trata durante al menos 3 semanas.
Tratamiento de meningitis causada por organismos gram-positivos : debido a que existe sinergismo entre ampicilina y aminoglucósidos para la mayoría de EGB, L. monocytogenes y enterococos, se recomienda la terapia de combinación hasta que se esteriliza el LCR. Si se determina que el EGB es un organismo tolerante, la terapia de combinación se debe utilizar toda la duración del tratamiento (aproximadamente 14 días)
Remington JS, Klein JO, Wilson CB, et al. Infectious diseases of the fetus and newborn: expert consult—online and print. 7th ed. Philadelphia: Saunders; 2010.
5.- ¿Qué más debemos incluir en el diagnóstico diferencial de un neonato con signos clínicos de meningitis ó sepsis cuyos resultados de cultivos de bacterias permanecen negativos ?
Dos infecciones virales deben ser consideradas.
La primera es Herpes virus (HSV) diseminado con afectación del SNC. Una pista de diagnóstico útil es el desarrollo de vesículas de la piel, lo cual puede también ser utilizado como fuente desde la cual aislar virus para el diagnóstico. Sin embargo, alrededor del 20% de los niños con esta forma de HSV nunca desarrollan vesículas en la piel. Otras fuentes para la detección del virus incluyen secreciones respiratorias, sangre y LCR. Si existe una fuerte sospecha de infección por HSV , debe iniciarse terapia con aciclovir mientras están pendientes la PCR (reacción de polimerasa viral en cadena) y los cultivos.
Las otras infecciones virales asociadas con el síndrome de sepsis neonatal grave son infecciones por enterovirus (especialmente Coxsackievirus).
V.- Infecciones por Estreptococo grupo B (EGB)
1.- ¿ Cuáles son los patterns de colonización por EGB durante el embarazo ?
Entre 10% y 30% de las mujeres están colonizadas con EGB en su canal de parto. Se han descrito patrones crónicos, intermitentes ó transitorios de colonización por EGB. La embarazada con colonización por EGB tiene 25 veces más probabilidad de dar a luz un neonato con sepsis de inicio precoz por EGB que las mujeres cuyos cultivos son negativos (aunque neonatos con EGB de inicio precoz han nacido de mujeres con cultivos prenatales negativos). Los niños afectados se infectan durante el trabajo de parto y parto. En ausencia de profilaxis intraparto, 2% de los niños desarrollará sepsis de inicio tardío por EGB.
Remington JS, Klein JO, Wilson CB, et al. Infectious diseases of the fetus and newborn: expert consult—online and print. 7th ed. Philadelphia: Saunders; 2010.
2.- ¿ Cuándo a las mujeres se les debería hacer screening para detectar colonización EGB ?
Se ha recomendado screening universal de todas las embarazadas a las 35 a 37 semanas de gestación desde 2002. Las muestras deben ser obtenidas de la parte inferior del recto y vagina y colocadas en un medio de caldo selectivo. Esta etapa de enriquecimiento aumenta significativamente la sensibilidad de la prueba con al menos un rendimiento dos veces mayor de los resultados de cultivos positivos que los métodos no selectivos.
Por otro lado, los métodos de laboratorio estándar para el aislamiento de EGB de la sangre y líquido cefalorraquídeo son completamente adecuados. Pruebas de amplificación de ácido nucleico (NAATs), incluyendo PCR para EGB pueden ser usadas para screening de embarazadas a término sin otros factores de riesgo, pero no deben reemplazar los cultivos antenatales tradicionales , ya que tienen menor sensibilidad. Medios cromogénicos pueden facilitar la detección de EGB beta hemolítico , pero no pueden detectar las cepas no hemolíticas.
Faro J, Katz A, Bishop K, et al. Rapid diagnostic test for identifying group B streptococcus. Am J Perinatol 2011;28(10):811–4.
de Zoysa A, Edwards K, Gharbia S, et al. Non-culture detection of Streptococcus agalactiae (Lancefield group B Streptococcus) in clinical samples by real-time PCR. J Med Microbiol 2012;61(Pt 8):1086–90.
Schrag SJ, Zell ER, Lynfield R, et al. A population-based comparison of strategies to prevent early-onset group B streptococcal disease in neonates. N Engl J Med 2002;347(4):233–9.
3,. ¿ Cuántos serotipos de EGB han sido identificados ? ¿ Cuál es signficado clínico e inmunológico de los serotipos ?
Diez serotipos han sido identificados sobre la base de antígenos capsulares polisacáridos. Los primeros estudios de la enfermedad por EGB en Norteamérica demostraron un predominio del serotipo tipo III, que se piensa que es el serotipo más virulento. Actualmente, el tipo III es responsable de aproximadamente el 70% de neonatos con meningitis y es aislado en casi dos tercios de los niños con enfermedades de inicio tardío. Desde la década de 1970 se ha producido un cambio progresivo en la serotipos predominantes, siendo ahora el tipo "Ia" la principal causa de infección de inicio precoz. Los tipos VI, VII, VIII y IX no suelen causar enfermedades humanas en el Reino Unido ó Estados Unidos, pero en todo el mundo su distribución varía (por ejemplo, los tipos VI y VIII, son las cepas más comunes en mujeres japonesas sanas). Desde una perspectiva de salud inmunológica y pública, el reconocimiento de múltiples serotipos nuevos ha confundido los esfuerzos de los investigadores para desarrollar una vacuna multivalente eficaz para prevenir esta enfermedad en recién nacidos.
Remington JS, Klein JO, Wilson CB, et al. Infectious diseases of the fetus and newborn: expert consult - online and print. 7th ed. Philadelphia: Saunders; 2010.
4.- ¿ Qué antibiótico debe usarse para profilaxis intraparto ?
Penicilina (3 g [5 millones de unidades] intravenosa seguidos de 1,5 a 1,8 g [2,5-3.000.000 unidades] administradas cada 4 horas por lo menos 4 horas antes del parto) es el agente de primera línea para la prevención de la enfermedad por EGB de inicio precoz. La ampicilina es una alternativa eficaz. La cefazolina (cefalosporina de primera generación) se prefiere para las mujeres alérgicas a penicilina en bajo riesgo de anafilaxia.
Stafford IA, Stewart RD, Sheffield JS, et al. Efficacy of maternal and neonatal chemoprophylaxis for early-onset group B streptococcal disease. Obstet Gynecol 2012;120(1):123–9.
5.- ¿ Puede usarse clindamicina para profilaxis antibiótica intraparto (PAI) en mujeres con alergia a penicilina ?
La cepa de la madre debe ser testeada para sensibilidad a clindamicina y resistencia inducible (test D-zona) porque el 25% de las cepas de EGB son resistentes a clindamicina. Si el test no está disponible, no se debe utilizar clindamicina.
La eritromicina no debe ser utilizada para PAI .
La vancomicina es el fármaco recomendado para embarazadas con reacciones alérgicas grave si la cepa no ha sido testeada para susceptibilidad a clindamicina. La PAI con vancomicina es probablemente eficaz, pero se considera inadecuada (en términos de manejo neonatal), debido a la falta de datos de eficacia.
6.- ¿ Cuáles embarazadas deben recibir PAI para prevenir sepsis de inicio precoz ?
Según el American College of Obstetrics and Gynecology (ACOG), las siguientes mujeres deben recibir profilaxis antibiótica:
Colonización prenatal con EGB (a excepción de las mujeres que tienen parto por cesárea sin trabajo de parto ó ruptura de membrana)
Status de colonizacion EGB desconocido y cualquiera de los siguientes: trabajo de parto prematuro, fiebre materna (38 ° C ó más), ruptura prolongada de membranas (18 horas o más) ó NAAT positivo para EGB intraparto.
Bacteriuria por EGB durante el embarazo (104 ó más unidades formadoras de colonias / ml)
Parto previo de neonato con EGB invasivo
Committee on Infectious Diseases, Committee on Fetus and Newborn, Baker CJ, et al. Policy statement—recommendations for the prevention of perinatal group B streptococcal (GBS) disease. Pediatrics 2011;128(3):611–6.
Puntos claves : aproximación actual a GBS
En ausencia de profilaxis intraparto, 2% de los niños desarrollará sepsis de inicio precoz por EGB.
Screening a todas las mujeres embarazadas entre 35 y 37 semanas de gestación para colonización por EGB.
Administrar profilaxis antibiótica intraparto a las mujeres con colonización antenatal con EGB , mujeres con parto previo con niño infectado, mujeres con bacteriuria positiva por EGB y madres de alto riesgo con status de colonización EGB desconocido.
7.- ¿ Cuáles son los pros y contras de PAI ?
Pros :
PAI
se ha traducido en una drástica reducción de la incidencia de enfermedad
de inicio precoz según datos de
los centros de vigilancia de los Centros para el Control y Prevención de
Enfermedades (CDC ) ,
un estudio
multicéntrico del
National Institute of Child Health
and Development
que revisó las tasas de
enfermedad desde
1992
a 1997
y
vigilancia permanente en el centro del
autor.
La incidencia de la enfermedad
desde 1990 hasta 1993 representan la era pre - PAI , mientras que los datos de
1993 a 1996 son posteriores a las recomendaciones de
la
ACOG and
American Academy of Pediatrics (AAP)
publicadas en 1993 . El tercer conjunto de datos refleja el
impacto de las recomendaciones de los CDC publicado en 1996 .
Contras:
Riesgo de anafilaxia materna
PAI no es 100 % eficaz ; 20% de los casos ocurrió a pesar de antibióticos intraparto
La estrategia basada en el screening sólo identifica máximo 85 % a 90 % de las madres de neonatos afectados.
Aparición de organismos resistentes en madres y neonatos ( Ej ; E. coli , especies de Enterococcus )
Aumento de resistencia del EGB a clindamicina y eritromicina
No aborda otros outcomes adversos de infección por EGB en embarazo ( Ej; pérdida fetal precoz; trabajo de parto prematuro, ruptura prematura de membranas fetales.
Cagno CK, Pettit JM, Weiss BD. Prevention of perinatal group B streptococcal disease: updated CDC guideline. Am Fam Physician 2012;86(1):59–65.
Schrag SJ, Zywicki S, Farley MM, et al. Group B streptococcal disease in the era of intrapartum antibiotic prophylaxis. N Engl J Med 2000;342(1):15–20.
8.- ¿ Cuáles son las nuevas recomendaciones del CDC para el manejo de neonatos ?
En 2010 el CDC publicó nuevas Guías para la Prevención de la sepsis de inicio precoz por EGB. Estas se resumen en la Figura 13-5.
(http://www.cdc.gov/groupbstrep/guidelines/index.html).
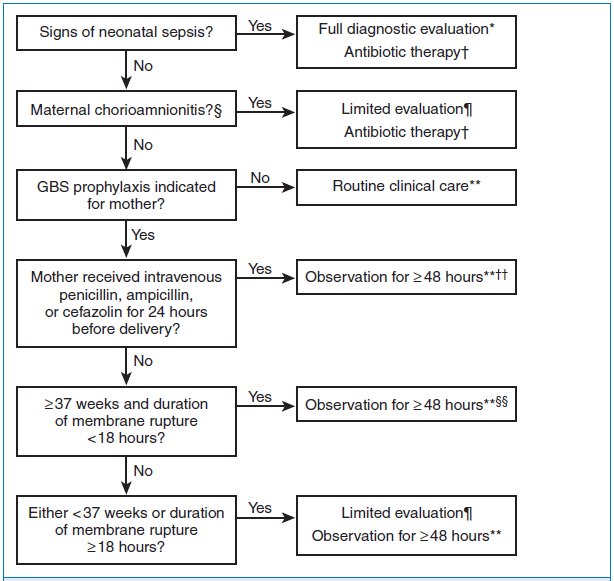
Figure 13-5. Algoritmo para prevención secundaria de enfermedad por estreptococo grupo B de inicio precoz entre neonatos. (Randis TM, Polin RA. Early-Onset group B Streptococcal sepsis: new recommendations from the Centres for Diseases Control and Prevention. Arch Dis Child Fetal Neonatal Ed 2012;97(4):F291–4.)
* Evaluación diagnóstica completa
incluye un hemocultivo, un recuento sanguíneo completo ( CBC)
incluyendo
recuento diferencial de
leucocitos y recuento de plaquetas , radiografía de tórax ( si
hay anormalidades respiratorias) y punción lumbar ( si el
paciente está lo suficientemente estable como para tolerar el procedimiento y
se sospecha sepsis) .
† El tratamiento antibiótico debe orientarse hacia las causas más comunes de
sepsis neonatal , incluyendo ampicilina por vía intravenosa para
EGB y cobertura para otros organismos (incluyendo Escherichia coli y otros patógenos
gram-negativos ) y debe tener en cuenta los patrones de resistencia a
antibióticos locales.
§ Consulta con
los obstetras tratantes es importante para determinar el
nivel de sospecha clínica de corioamnionitis. La corioamnionitis se diagnostica
clínicamente y algunos de los signos son inespecíficos.
¶ Evaluación limitada incluye hemocultivo ( al nacer) y
Recuento diferencial de leucocitos y de plaquetas (al nacer y / o a las 6-12 horas de
vida) .
** Si se desarrollan signos de sepsis , debe realizarse una
evaluación diagnóstica completa
y debe iniciarse tratamiento con antibióticos.
† †
Si gestación ≥ 37 semanas
la observación puede
hacerse en la casa después de
24 horas si se cumplen otros criterios de alta , el acceso al
cuidado médico
está
fácilmente disponible
y una persona que es capaz de cumplir
plenamente las instrucciones para la observación en casa estará presente .
Si alguna de estas condiciones no se cumple , el niño debe ser observado en el
hospital durante al menos 48 horas y hasta que se alcanzan los criterios de alta
.
§ § Algunos expertos recomiendan un hemograma completo con
recuento diferencial de
leucocitos y de plaquetas a las
6 -
12 horas
de edad.
9.- ¿ Es la colonización materna tardía responsable del alto número de screening EGB negativos en las embarazadas que posteriormente dan a luz neonatos con infección por EGB de inicio precoz ?
Un análisis
retrospectivo reciente reveló que las mujeres a las cuales se
les realiza screening para EGB en el
momento del
trabajo de parto tienen
más probabilidad
de
tener cultivos falsos negativos
que aquellas a las que se les realiza screening entre
las
35 y 37 semanas de gestación.
Este estudio afirma que la mayoría de los
screening
falsos negativos
resultan
de recolección ó procesamiento
inadecuados
de las muestras. Otro
desafío permanente es la adherencia a las guías clínicas actuales, las
oportunidades perdidas para prevención del EGB ocurren con frecuencia,
especialmente entre las mujeres que da a luz a recién nacidos prematuros.
10.- ¿ Cuál es la historia natural de adquisición nosocomial de EGB en enfermedad de inicio tardío ?
La mayoría de los neonatos que contraen la enfermedad de inicio tardío adquieren el organismo fuera del hospital. Las madres de estos niños pueden no tener ninguna historia de colonización genital con EGB durante el embaraz
o.Sass L. Group B streptococcal infections. Pediatr Rev 2012;33(5):219–24–quiz224–5.
VI.- Estafilococo epidermidis (estafiloco coagulasa negativo ó CoNS)
1.- ¿ Son los CoNS patógenos comunes en la UCIN ?
Los CoNS son comensales de flora de piel y mucosas. Casi el 99% de los recién nacidos sanos tendrán hisopados de nariz ú ombligo positivos para CoNS al día 4 de vida. Sin embargo, estos organismos también son responsables de hasta la mitad de las infecciones del torrente sanguíneo en neonatos de MBPN (<1.500 g) .
Kilbride HW, Wirtschafter DD, Powers RJ, et al. Implementation of evidence-based potentially better practices to decrease nosocomial infections. Pediatrics 2003;111(4 Pt 2):e519–33.
2.- ¿ Porqué ha aumentado la conciencia de CoNS en la UCIN en la últimas décadas ?
La mejora de las tasas de sobrevida de los recién nacidos de MBPN se han traducido en un mayor riesgo de sepsis debido a las muchas terapias invasivas requeridas para el manejo, tales como los catéteres venosos centrales.
Las líneas centrales están asociados con un mayor riesgo de bacteriemia por CoNS. La colonización precede a la infección por esta especie. Por lo tanto las infecciones CoNS presentan un dilema particular debido a que su aislamiento de un hemocultivo único en un recién nacido puede estar reflejando contaminación ó bacteriemia verdadera. Un algoritmo sugerido para interpretación de hemocultivos positivos causados por CoNS se muestra en la Figura 13-6.
Craft A, Finer N. Nosocomial coagulase negative staphylococcal (CoNS) catheter-related sepsis in preterm infants: definition, diagnosis, prophylaxis, and prevention. J Perinatol 2001;21(3):186–92.

3.- ¿ Son los hemocultivos tomados desde catéteres intravasculares fáciles de interpretar ?
Los catéteres de vasos umbilicales e intravasculares son esenciales en la UCIN y los resultados de los hemocultivos pueden originar interpretaciones ambiguas (por ejemplo, contaminación versus colonización del catéter versus infección sistémica). Algunas de las características microbiológicas pueden ser útiles para ayudar en esta decisión, tales como el tiempo de crecimiento (mientras más largo el tiempo transcurrido entre la obtención del hemocultivo y su crecimiento, lo más probable es que represente un contaminante), el número de cultivos positivos (especialmente si se obtienen de diferentes fuentes, periférico y central), los organismos aislados (contaminación es más probable cuando crecen varios especímenes ) y signos clínicos.
Healy CM, Baker CJ, Palazzi DL, et al. Distinguishing true coagulase-negative Staphylococcus infections from contaminants in the neonatal intensive care unit. J Perinatol 2013;33(1):52–8.
Struthers S, Underhill H, Albersheim S, et al. A comparison of two versus one blood culture in the diagnosis and treatment of coagulase-negative staphylococcus in the neonatal intensive care unit. J Perinatol 2002;22(7):547–9.
4.- La manifestación más común de infección por CoNS es bacteriemia y sepsis, pero ¿cuáles son las complicaciones focales de bacteriemia persistente con CoNS ?
Endocarditis: especialmente si hay bacteriemia de catéter central prolongado ó cardiopatía congénita
Infecciones de tejidos blandos : pustulosis, infecciones de senos (mastitis) , onfalitis.
Neumonía
Meningitis, absceso cerebral : sobre todo si se colocan derivaciones ventrículo-peritoneales
Enterocolitis necrotizante
Isaacs D, Australasian Study Group for Neonatal Infections. A ten year, multicentre study of coagulase negative staphylococcal infections in Australasian neonatal units. Arch Dis Child Fetal Neonatal Ed 2003;88(2):F89–93.
5.- ¿ Cuál es la terapia recomendada para infección por CoNS ?
La terapia inicial recomendada es Vancomicina, que puede ser modificada una vez que se conoce la susceptibilidad del aislado. En los casos de bacteriemia persistente, una combinación de vancomicina y rifampicina puede aumentar la eficacia. Cuando un catéter permanente debe dejarse en su lugar, la terapia con antibióticos debe ser administrada a través del catéter. La remoción del catéter puede ser necesaria si el cultivo sigue siendo positivo. Lo mismo se aplica para otros dispositivos médicos, tales como meningitis resultante de una derivación ventrículo-peritoneal infectada.
6.- ¿ Debe usarse profilaxis con vancomycin para prevenir sepsis nosocomial por CoNS?
Debido a las preocupaciones con respecto a la aparición de microorganismos resistentes a vancomicina, no se recomienda
actualmente el uso rutinario de vancomicina profiláctica para todos los recién nacidos en riesgo de bacteriemia por CoNS.Kilbride HW, Powers R, Wirtschafter DD, et al. Evaluation and development of potentially better practices to prevent neonatal nosocomial bacteremia. Pediatrics 2003;111(4 Pt 2):e504–18.
Karlowicz MG, Buescher ES, Surka AE. Fulminant late-onset sepsis in a neonatal intensive care unit, 1988-1997, and the impact of avoiding empiric vancomycin therapy. Pediatrics 2000;106(6):1387–90.