Crecimiento intrahospitalario de prematuros
Febrero 2016
Mejora del crecimiento en prematuros durante la estadía hospitalaria inicial : de los principios a la práctica
Richard J Cooke Arch Dis Child Fetal Neonatal Ed 2016
Introducción
A pesar de las recientes innovaciones, es
decir, nutrición parenteral precoz / agresiva (NP), 1,21
nutrición enteral precoz (NE) con leche humana / uso de fortificadores de leche
humana 2 y / o fórmulas para prematuros, la falta de
crecimiento postnatal (PGF) entre el nacimiento yel alta hospitalaria
sigue siendo un problema significativo en prematuros ; mientras más
pequeño / más inmaduro es el prematuro, mayor es la severidad.3,4
Es muy importante considerar la malnutrición durante esta época
crítica del desarrollo. Los nutrientes juegan un rol fundamental en la promoción
de la salud normal y la prevención de la enfermedad, 5 mientras que
la desnutrición está directamente relacionada con alteraciones en la
estructura/función de órganos y en paralelo con el aumento de la morbilidad y la
mortalidad en adultos. 5 En lactantes/niños, la desnutrición es
acompañada de alteraciones en funciones inmunes, gastrointestinal y pulmonar,
así como tambien desarrollo retrasado.6 Los
estudios también sugieren que el crecimiento está "preprogramado" para
ocurrir en un determinado momento ó época "crítica" la cual si se pasa no puede
ser recuperable.7
Por lo tanto, incluso cortos períodos de deprivación nutricional pueden tener
efectos a largo plazo sobre la estructura/función de un órgano; por ejemplo,
crecimiento del cerebro y desarrollo.7 Las preocupaciones en los
lactantes se magnifican en prematuros, debido a que el crecimiento, el principal
determinante de las necesidades, es mucho más rápido. Así, en recién nacidos a
término, el peso corporal aumenta de 3.250 a 13,0 kg entre el nacimiento y los
24 meses. En los prematuros, el peso corporal aumenta de 0,65 a 3,25 kg entre
las 24 y las 40 semanas, casi cinco veces más rápido. Los órganos y sistemas
también son más inmaduros, por lo tanto, más vulnerables. Si bien es evidente
que el pobre crecimiento está relacionado con pobre desarrollo en neonatos a
término y pretérmino 8, también es evidente que la intervención
nutricional, por ejemplo, aumento de ingesta de proteínas en la primera semana
de vida 9,10 ó alimentación con fórmula enriquecida con nutrientes,
11 puede mejorar significativamente el outcome ó
resultado durante esta época crítica del desarrollo.
Una mejor comprensión de los factores que contribuyen al desarrollo de PGF
(falla de crecimiento postnatal) es crucial. Si es ó no completamente
"prevenible" no está claro. Lo que está claro es que :
La gravedad de PGF varía significativamente entre las unidades de cuidados intensivos neonatales (UCIN), 3,4,12,13
La introducción de un protocolo de alimentación estandarizada mejora el crecimiento 14-17 pero que .
Las necesidades nutricionales no son las mismas para todos los neonatos.
Estas cuestiones, junto con el papel clave que un equipo de apoyo nutricional desempeña en la mejora del crecimiento en prematuros se abordarán en esta revisión.
Falla de crecimiento postnatal
PGF entre el nacimiento y el alta hospitalaria parece inevitable en el prematuro, en particular el RN de muy bajo peso al nacer (RNMBPN) .18 Varios factores contribuyen. Se necesita tiempo para establecer una ingesta adecuada y, una vez establecida, se interrumpe frecuentemente debido a una enfermedad intercurrente.
Lo que es /no es adecuado, en particular durante la fase aguda de la enfermedad, no está del todo claro. Además, las mediciones oportunas/sensibles/robustas de los resultados no están completamente consensuadas. Consideraciones adicionales son las siguientes. Las recomendaciones actuales son que una vez que el peso al nacer se ha recuperado, el crecimiento debe ser paralelo al del feto de la misma edad gestacional .19,20 Se piensa que la pérdida de peso precoz refleja los cambios en líquidos como el agua corporal total que disminuye de 85% a 70% .21,22 En estudios clínicos que examinan esta cuestión, los RN fueron sistemáticamente subalimentados.23-25 Para separar lo que es fisiológico, es decir, cambios normales en fluídos, de lo que es patológico, es decir, asociados con el catabolismo, 26 no hay un punto de corte claro.
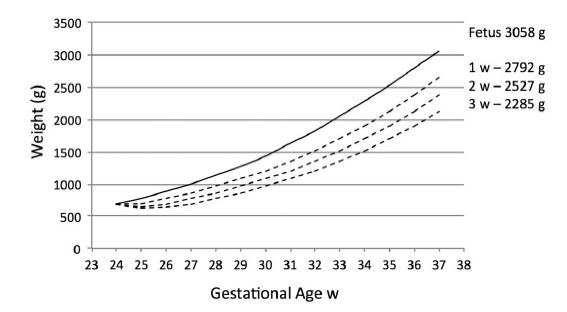
Las recomendaciones actuales para apuntar a tasas de crecimiento varían de 15 a 20 g / kg / día. 27-29 Debido a la preocupación acerca de "crecimiento demasiado rápido" , Klein30 sugiere una tasa de 17 g / kg / día. Por lo tanto, un prematuro de 24 semanas, PN 690 g AEG masculino que recupera el peso al nacer al final de la primera, segunda y tercera semanas tendrá un peso de 2800 g, 2527 g y 2285 g, sustancialmente menor que el feto, 3.085 g a las 37 semanas (Figura 1), pero significativamente mayor que el de 24 semanas 525 g SPEG 1932 g, que también crece a 17 g / kg / día (Figura 2).

Figura 1.- Comparación del crecimiento fetal y postnatal entre 24 y 37 semanas en neonato de 24 semanas AEG que recupera peso de nacimiento al nacer a las semanas 1, 2 y 3 de edad y crece a 17 g / kg / día.
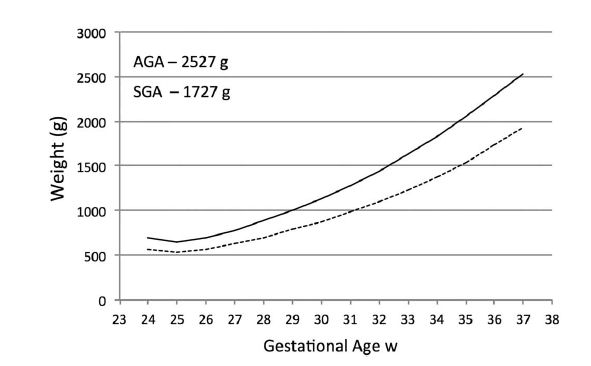
Figura 2.- Comparación del crecimiento postnatal en un neonato de 690 g, 24 semanas AEG y de 500 g, 24 semanas PEG que recuperan peso de nacimiento a las 2 semanas y crecen a 17 g / g / kg / día.
El uso del crecimiento fetal como estándar de referencia para el crecimiento posnatal ha sido cuestionado.27 Fundamental para la construcción de curvas de crecimiento fetal es la idea de que los Recién nacidos prematuramente son "normales" y el tamaño al nacer representa un crecimiento "óptimo". Esto puede no ser del todo cierto. En recién nacidos a término, el crecimiento fetal muestra un aumento rápido y consistente durante el tercer trimestre del embarazo hasta las 37 semanas, de crecimiento "tambaleante ó vacilante " antes del nacimiento y después crecimiento "catch up " ó "puesta al día' poco después del nacimiento. Esto ha llevado a la sugestión de que el crecimiento después de 37 semanas es de alguna manera "restringido" y que el peso medio al nacer es inferior a "óptimo", incluso en el RN a término normal.31
Tal consideración puede ser mayor en los prematuros debido a que:
Hasta 50% de los partos prematuros están asociados con insuficiencia placentaria.32
Peso al momento del parto es consistentemente menor que el peso fetal, según lo determinado por ecografía.33,34
Casi 40% de los RN nacidos prematuramente son pequeños para edad gestacional (PEG) .34
Estos datos sugieren que los RN nacidos prematuramente son de bajo crecimiento (undergrown). El crecimiento apuntando ("targeting" ) a un peso subóptimo estará sistemáticamente haciendo un "cálculo aproximado" bajo para el crecimiento potencial y por tanto para las necesidades de nutrientes; mientras más pequeño es el prematuro, mayor será el efecto.
Además, las ingestas recomendadas se basan en las necesidades para mantenimiento y crecimiento "normal". Sin embargo, todos los RN de MBPN acumulan un déficit nutricional importante durante la vida precoz.18 No se tiene en cuenta lo necesario para la "recuperación" ó crecimiento "catch up ó ponerse al día", lo que agrava aún más el problema.
Protocolo de alimentación estandarizado / Auditoría
Cada equipo neonatal sabe cómo alimentar a un "prematuro" y lo hace con diferentes grados de éxito; es decir, los estudios muestran que la frecuencia / gravedad de la falta de crecimiento varía significativamente entre UCINs.12,13
El primer paso para mejorar el crecimiento, por lo tanto, es delinear la extensión del problema en una UCIN individual. Esto se puede hacer mediante la conversión de peso corporal al nacer y al alta hospitalaria a Z - score (ZS), restando luego el primera desde el último.13,18
Asumiendo que hay un problema, se debe determinar la ingesta de energía y proteínas (prescrita y actual) y en el proceso, las prácticas de NP y NE necesitan ser evaluadas. Las áreas de especial interés deben incluir :
Momento después de ingreso a UCIN de introducción de NP así como tambien la composición de la solución (s).
Transición desde NP a NE , un momento en que la NP se disminuye ml a ml a medida que se aumenta la NE. Debido a que la densidad de nutrientes es mayor con NP que con NE , la ingesta real, por ejemplo, proteínas, puede disminuir.
Manejo Nutricional durante los episodios " NPO" ó nada por boca , perído cuando se suspende la NE debido a "preocupación" y NP y/o NE pueden no ser reiniciadas en el momento oportuno.
Una vez que se mide la ingesta, los déficits de energía y proteínas acumulativos pueden estar directamente relacionados con la falla de crecimiento. Sin embargo, los factores no nutricionales también afectan significativamente el crecimiento. En el estudio de Embleton y cols 18 , menos del 50% de variación en déficit de crecimiento estaba relacionado con ingesta inadecuada de energía y proteínas. En el estudio más reciente de Griffin y cols 3 , también se demuestra que factores no nutricionales afectan adversamente el crecimiento.
Esto no es sorprendente debido a que la "enfermedad" tiene un efecto significativo sobre el status nutricional, es decir, disminuye la ingesta, altera la asimilación de nutrientes y aumenta los requerimientos.6
Independientemente, los siguientes hechos importantes son recogidos consistentemente de una auditoría "interna" .13,18,35
Lo que se cree que está ocurriendo y lo que realmente estaba sucediendo no era siempre lo mismo.
Lo que se prescribe y lo que posteriormente se administra también puede variar.
Las prácticas de alimentación varían, en algunos casos, dependiendo de la preferencia del médico individual.
Una vez que los datos están disponible se hace más fácil de persuadir al personal médico y de matronería que existe un "problema" y se adopte un enfoque más coherente basada en evidencia.
Lo que los datos observacionales sugieren en gran medida es que, independientemente del protocolo, la morbilidad 14-17,36,37 disminuye y el crecimiento mejora 38-40 después de la introducción de un protocolo de alimentación estandarizado en UCIN ; es decir, "cuando todo el mundo está en la misma página los outcomes ó resultados mejoran".
Cuidado / Monitoreo nutricional individualizado
Las recomendaciones sobre requerimientos nutricionales del prematuro 30 asumen que "todos son de la misma talla". Esto claramente no es el caso.
Algunos prematuros crecen apropiadamente "in útero", es decir son AEG, algunos no lo son; es decir, hasta 40% son PEG.33,34
Gravedad / tipo de enfermedad es variable, lo que afecta significativamente el status nutricional. 6,26 Mientras más es la enfermedad, mayor es el deficit nutricional acumulado. 41,42
Las necesidades son una función de la velocidad "programada" y de la composición de crecimiento. Los niños crecen más rápido que las niñas en el último trimestre 43 y por tanto las necesidades es probable que difieran.
La intervención (es) médicas alteran las necesidades / status nutricional.
El gasto energético se reduce hasta 25% en prematuros que reciben presión respiratoria positiva continua nasal pero aumenta significativamente con terapia de metilxantinas. 44
Los diuréticos alteran el balance de líquidos y electrolitos 45, así como tambien la homeostasis del calcio, 46 por lo tanto tienen un efecto significativo sobre el crecimiento.
Los esteroides también tienen un efecto significativo en el metabolismo intermediario y puede estar directamente relacionados con alteraciones en el crecimiento y desarrollo postnatal.47-51
El primer paso, por lo tanto, cuando se hace la "individualización" es revisar la necesidad de tal intervención (s), con el fin de suspender tan pronto como esté médicamente indicado. El segundo paso es evaluar el estado nutricional de cada neonato.
El peso y la longitud cráneo-talón (CHL) deben ser medidos con precisión, convirtiendo los datos a Z-S. Restando ZS en un punto de tiempo determinado deaquel al nacer reflejará la gravedad del déficit peso / linear . Una CHL exacta no suele estar disponible al nacer, pero debe obtenerse tan pronto como sea posible.
La exactitud / precisión de las determinaciones antropométricas juega un rol crucial en "adaptar" la ingesta para satisfacer las necesidades, es decir, asegurar peso y crecimiento lineal, como mínimo, paralelo al crecimiento "in útero". 19,20 A este respecto, se plantean dos preguntas. ¿Quién debe realizar y con qué frecuencia se debe hacer estas mediciones ? Dada la extensión / gravedad de PGF (falla de crecimiento postnatal) en el Servicio de Neonatología la antropometría y se debe realizar una doble comprobación por los que tienen una probada "experiencia" en esta área , es decir, son capaces de medir con precisión y seguridad el peso, CHL y la circunferencia cefálica. Las velocidades de aumento se pueden calcular entonces y evaluar la adecuación del crecimiento.
El crecimiento
lineal es considerado como la mejor medida de evaluación de la adecuación de
ingesta dietética.52 Sin embargo, es difícil medir CHL de manera
precisa y reproducible.53 La medición de distancia
rodilla - talón ha sido por tanto recomendada 54 pero no ha sido confirmada como un indicador exacto / preciso del
crecimiento linear total.55 El foco, por lo tanto, ha sido el
peso corporal, ya que puede ser medido con precisión y reproductibilidad.
Se recomienda que se determine el peso corporal y se represente
en una curva de referencia y el patrón sea
seguido en el tiempo.19,30 Este enfoque, aunque práctico y simple, no es una
forma sensible de detectar falla de crecimiento.53 Esto se ilustra en la
Figura
3. La ganancia de Peso ganancia disminuye de manera significativa entre las 36 semanas y
el término (40 s) ,
pero esto no es perceptible cuando se traza el peso para edad.
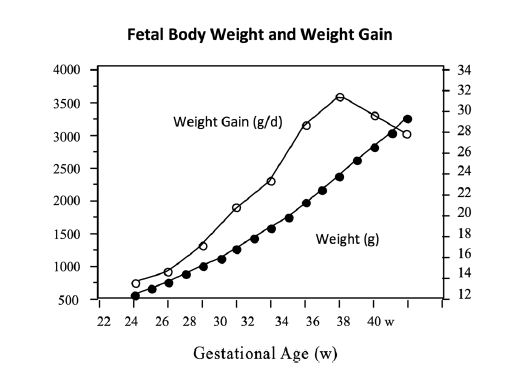
Figura 3 .- Peso corporal fetal y ganancia diaria de peso entre 24 y 40 semanas de gestación.
Por lo tanto, se recomienda el aumento de peso diario.19,30 Sin embargo, la validez de este enfoque debe ser cuestionado. En primer lugar, el crecimiento no es un fenómeno lineal, ya que a veces se asume desde las curvas de crecimiento "suavizadas". Ellas se caracterizan por una serie continua de mini crecimientos repentinos seguidos de estancamiento, 56 lo cual también es conocido como "brotes y estasia'.57 Dependiendo del tiempo, por lo general días en lugar de semanas, 56 esta alternancia de mini crecimientos / desaceleraciones confundirán constantemente la interpretación de ganancia diaria de peso en el RN de MBPN.
Otras limitaciones de este enfoque son las siguientes :
La mayoría de las balanzas tienen una precisión de 10 g, pero se producen errores (s). En un neonato de 27 semanas se mide peso en 1.007 g. Luego, aumenta 15 g / kg / día (1,5%), se observa que pesa 1.118 g 7 días más tarde. Si se ha cometido un error de 10 g al inicio del estudio (línea de base) , es decir, el neonato pesó 1.017 g y un error de - 10 g había sido hecho 7 días más tarde, es decir, el peso del niño es 1,108 g, entonces la velocidad de ganancia se calcula en 13 g / día, una diferencia de ~2.9 g / kg / día. A medida que el intervalo de tiempo entre las determinaciones de peso disminuye de 7 a 1 días, el error aumenta ~2.9 - 20 g / kg / día (Figura 4).
Momento de pesaje con referencia a :
Alimentación : un neonato de 1.250 alimentado con ingesta enteral de 120 kcal / kg / día recibirá ~188 ml / día de una fórmula de 24 kcal / onza ó aproximadamente 16 ml por alimentación cada 2 h. Si el neonato se pesa después de las alimentaciones en una ocasión (+ 16 g) y antes de las alimentaciones en la siguiente ocasión, entonces la velocidad de crecimiento diaria puede ser interpretada erróneamente.
Micción / defecación donde como en 2A pueden cometerse errores.
Figura 4.- Error en la determinación de ganancia de peso (g / kg / día) graficado como función del intervalo de tiempo entre mediciones de peso.
¿ Son las determinaciones diarias de peso, por lo tanto, justificables en RN de MBPN por lo demás normal ?
Para examinar esta pregunta , Florendo y cols 58 pesaron dos grupos de RN de MBPN el día 1. A continuación, asumiendo un aumento de peso de 25 g / día, indicaron una ingesta "target" u "objetivo" de 120 kcal / kg / día durante los siguientes 4 días. Los recién nacidos se volvieron a pesar entonces y se repitió el proceso durante tres días más. Durante el período de estudio de 3 semanas, la ingesta promedio fué de 118 y 119 kcal / kg / día en los dos grupos, notablemente cercana al "objetivo" y en forma paralela con aumento de peso de 28 g / día.
Las implicancias de estos hallazgos son
importantes. Se invierte tiempo / recursos significativos en la realización
de las mediciones diarias de peso. Una disminución de ~ 70% significa que más
esfuerzo puede ser empleado para antropometría precisa, sobre todo
determinaciones de CHL. La importancia de esta último es muy importante.
La ingesta inadecuada de proteínas es un
factor contribuyente importante a PGF en neonatos prematuros.18,49
Además , el aumento de ingesta de proteínas puede estar directamente
relacionado con la mejora del outcome del crecimiento 9 y
desarrollo.10
La evaluación exacta / reproducible del crecimiento lineal es clave, en particular dadas las preocupaciones sobre "crecimiento demasiado rápido " y adiposidad alterada en estos neonatos de alto riesgo.59
Consideraciones adicionales al interpretar la relación entre ingesta y crecimiento son las siguientes :
A un neonato con peso basal de 1.250 g se le indica ingesta de 120 kcal / kg / día. Si el RN está creciendo adecuadamente, es decir, 1,5% / día, entonces el RN tendrá un peso de ~ 1.269 g 1 día más tarde. El peso promedio para la intervención 24 h es 1.260 g e ingesta promedio de ~ 119 kcal / kg / día, un pequeño déficit diario pero aditivo a través de una estadía hospitalaria de 2-3 meses.
Siempre hay un lapso de tiempo entre la determinación del peso real, a veces la noche anterior y las visitas cuando los "problemas nutricionales se discuten" / órdenes por escrito y ajuste de la ingesta.
Las alimentaciones diarias también pueden ser interrumpidas por períodos variables de tiempo y / o los neonatos pueden regurgitar ó vomitar. La ingesta no siempre se reajusta para recuperar el déficit. En efecto, los neonatos tienden a ser alimentados menos y más bien que más de lo indicado regularmente , tema que al menos en parte, puede ser abordado mediante el enfoque de Florendo y cols.58
Team de soporte nutricional
El establecimiento del equipo de apoyo nutricional es clave para mejorar el crecimiento de los prematuros en la UCIN . Consiste en un núcleo (médico, nutricionista, químico farmacéutico, matrona, etc.) y este grupo debe tomar un rol conductor en el cuidado nutricional y en la enseñanza e investigación, con funciones más específicas que incluyen :
Auditoría:
Realizar , supervisar y evaluar los resultados de la auditoría.
Presentación de resultados de la auditoría, con el fin de obtener un consenso en cuanto al "mejor camino a seguir", es decir, el establecimiento de un protocolo basado en evidencia ó modificación de un protocolo existente.
Repetir la auditoría de manera regular.
Atención nutricional diaria / semanal en Servicio de Neonatología
Monitorizar crecimiento sistemáticamente (peso, lineal, cabeza).
Consulta / Asesoría a medida que surjan problemas nutricionales en neonatos individuales.
Educación continua de todo el personal pertinente (medicos, matronas, otros).
Identificación de los avances clave en el área, actualización de todo el personal, obtención de consenso, modificación del protocolo de alimentación y luego repetir la auditoría.
El valor de la CME y de la investigación deben ser resaltados. Pocas áreas están asociadas con más controversia que la alimentación de los prematuros. Hay varias razones para ésto. Los principios del cuidado nutricional no siempre se entienden / aplican por completo de manera consistente en el Servicio de Neonatología. También falta datos y / o son interpretados de manera diferente en muchas áreas clave. La educación médica continua (CME) juega un rol clave en volver a lo básico. Al mismo tiempo, la investigación clínica en curso, incluso simple, significa que siempre se están haciendo preguntas sobre la mejor manera de cuidar a este grupo más vulnerable de niños. "Lo más importante es no dejar de hacerse preguntas" (Albert Einstein).
Resumen
Se pueden tomar varias medidas para mejorar el crecimiento en prematuros entre el nacimiento y el alta hospitalaria.
Éstas incluyen :
Auditoría, para identificar la severidad / naturaleza del problema en un Unidad determinada.
Introducción de un protocolo de alimentación estandarizada que está basado en evidencia y monitoreado de manera regular.
Cuidado nutricional individualizado, con especial atención a:
Mediciones exactas de peso corporal y CHL.
Uso de desviación estándar ó Z - Score para monitorizar el crecimiento.
Establecimiento de un equipo de apoyo nutricional que apoye / supervise todos los aspectos del cuidado nutricional en el Servicio de Neonatología.
Repetición de auditoría 3 - 6 meses después de la introducción del protocolo de alimentación.
Referencias
Ziegler EE, Thureen PJ, Carlson SJ. Aggressive nutrition of the very low birthweight infant. Clin Perinatol 2002;29:225–44.
Henderson G, Fahey T, McGuire W. Multicomponent fortification of human breast milk for preterm infants following hospital discharge. Cochrane Database Syst Rev 2007;(4):CD004866.
Griffin IJ, Tancredi DJ, Bertino E, et al. Postnatal growth failure in very low birthweight infants born between 2005 and 2012. Arch Dis Child Fetal Neonatal Ed 2016;101:50–5.
Horbar JD, Ehrenkranz RA, Badger GJ, et al. Weight Growth Velocity and Postnatal Growth Failure in Infants 501 to 1500 Grams: 2000–2013. Pediatrics 2015;136: e84–92.
Shils ME, Shike M, Ross AC, et al. Modern nutrition in health and disease. Philadelphia: Lippincott Williams and Wilkins, 2006.
Mehta NM, Corkins MR, Lyman B, et al. Defining pediatric malnutrition: a paradigm shift toward etiology-related definitions. JPEN J Parenter Enteral Nutr 2013;37:460–81.
Dobbing J. The later development of the brain and its vulnerability. In: Davis JA, Dobbing J, eds. Scientific foundations of pediatrics. Baltimore: University Park Press, 1981:744–58.
Ehrenkranz RA, Dusick AM, Vohr BR, et al. Growth in the neonatal intensive care unit influences neurodevelopmental and growth outcomes of extremely low birth weight infants. Pediatrics 2006;117:1253–61.
Tonkin EL, Collins CT, Miller JM. Protein intake and growth in preterm infants: a systematic review. Global Pediatric Health 2014:1–20.
Stephens BE, Walden RV, Gargus RA, et al. First-week protein and energy intakes are associated with 18-month developmental outcomes in extremely low birth weight infants. Pediatrics 2009;123:1337–43.
Lucas A, Morley R, Cole TJ. Randomised trial of early diet in preterm babies and later intelligence quotient. Bmj 1998;317:1481–7.
Olsen IE, Richardson DK, Schmid CH, et al. Intersite differences in weight growth velocity of extremely premature infants. Pediatrics 2002;110:1125–32.
Cooke RJ, Ainsworth SB, Fenton AC. Postnatal growth retardation: a universal problem in preterm infants. Arch Dis Child Fetal Neonatal Ed 2004;89: F428–30.
Kamitsuka MD, Horton MK, Williams MA. The incidence of necrotizing enterocolitis after introducing standardized feeding schedules for infants between 1250 and 2500 grams and less than 35 weeks of gestation. Pediatrics 2000;105:379–84.
McCallie KR, Lee HC, Mayer O, et al. Improved outcomes with a standardized feeding protocol for very low birth weight infants. J Perinatol 2011;31(Suppl 1): S61–7.
Patole SK, de Klerk N. Impact of standardised feeding regimens on incidence of neonatal necrotising enterocolitis: a systematic review and meta-analysis of observational studies. Arch Dis Child Fetal Neonatal Ed 2005;90:F147–51.
Viswanathan S, McNelis K, Super D, et al. A standardized slow enteral feeding protocol and the incidence of necrotizing enterocolitis in extremely low birth weight infants. JPEN J Parenter Enteral Nutr 2015;39:644–54.
Embleton NE, Pang N, Cooke RJ. Postnatal malnutrition and growth retardation: an inevitable consequence of current recommendations in preterm infants? Pediatrics 2001;107:270–3.
AAPCON. Nutritional needs of preterm infants. In: Kleinman RE, ed. Pediatric nutrition handbook. Elk Groove Village: American Academy of Pediatrics, 1998:55–88.
AAPCON. Nutritional needs of the preterm infant. In: Kleinman RE, ed. Pediatric nutrition handbook. 6th edn. American Academy of Pediatrics, 2009:79–104.
Brace RA. Fluid distribution in the fetus and neonate. In: Poland RA, Fox WW, eds. Fetal and neonatal physiology. Philadelphia: WB Saunders Co, 1998:1703–13.
Ziegler EE, O’Donnell AM, Nelson SE, et al. Body composition of the reference fetus. Growth 1976;40:329–41.
Bauer K, Bovermann G, Roithmaier A, et al. Body composition, nutrition, and fluid balance during the first two weeks of life in preterm neonates weighing less than 1500 grams. J Pediatr 1991;118:615–20.
Carlson SJ, Ziegler EE. Nutrient intakes and growth of very low birth weight infants. Perinatol 1998;18:252–8.
Wilson DC, Cairns P, Halliday HL, et al. Randomised controlled trial of an aggressive nutritional regimen in sick very low birthweight infants. Arch Dis Child Fetal Neonatal Ed 1997;77:F4–11.
Lowry S, Perez JM. The hypercatabolic state. In: Shils M, Shike M, Ross CA, Caballero B, Cousins R, eds. Modern nutrition in health and disease. 10th edn. Philadelphia: Lippincott, Williams & Wilkins, 2006:1381–400.
Sparks JW. Human intrauterine growth and nutrient accretion. Semin Perinatol 1984;8:74–93.
Lubchenco LO. Intrauterine growth as estimated from liveborn birth-weight data at 24 to 42 weeks of gestation. Pediatr 1963;32:793–800.
Usher R, McLean F. Intrauterine growth of live-born Caucasian infants at sea level: standards obtained from measurements in 7 dimensions of infants born between 25 and 44 weeks of gestation. J Pediatr 1969;74:901–10.
Klein CJ. Nutrient requirements for preterm infant formulas. J Nutr 2002;132:1395S–577S.
Briend A. Normal fetal growth regulation: nutritional aspects. In: Gracey MG, Falkner F, eds. Nutritional needs and assessment of normal growth. New York: Raven Press, 1985:1–21.
Fedrick J, Adelstein P. Factors associated with low birth weight of infants delivered at term. Br J Obstet Gynaecol 1978;85:1–7.
Larsen T, Petersen S, Greisen G, et al. Normal fetal growth evaluated by longitudinal ultrasound examinations. Early Hum Dev 1990;24:37–45.
Greisen G. Estimation of fetal weight by ultrasound. Horm Res 1992;38:208–10.
Cooke RJ, Ford A, Werkman S, et al. Postnatal growth in infants born between 700 and 1,500 g. J Pediatr Gastroenterol Nutr 1993;16:130–5.
Patole SK, Kadalraja R, Tuladhar R, et al. Benefits of a standardised feeding regimen during a clinical trial in preterm neonates. Int J Clin Pract 2000;54:429–31.
Patole S. Prevention and treatment of necrotising enterocolitis in preterm neonates. Early Hum Dev 2007;83:635–42.
Moltu SJ, Blakstad EW, Strømmen K, et al. Enhanced feeding and diminished postnatal growth failure in very-low-birth-weight infants. J Pediatr Gastroenterol Nutr 2014;58:344–51.
Can E, Bülbül A, Uslu S, et al. Effects of aggressive parenteral nutrition on growth and clinical outcome in preterm infants. Pediatr Int 2012;54:869–74.
Ziegler EE. Meeting the nutritional needs of the low-birth-weight infant. Ann Nutr Metab 2011;58(Suppl 1):8–18.
Mrozek JD, Georgieff MK, Blazar BR, et al. Effect of sepsis syndrome on neonatal protein and energy metabolism. J Perinatol 2000;20:96–100.
Coss-Bu JA, Klish WJ, Walding D, et al. Energy metabolism, nitrogen balance, and substrate utilization in critically ill children. Am J Clin Nutr 2001;74:664–9.
Olsen IE, Groveman SA, Lawson ML, et al. New intrauterine growth curves based on United States data. Pediatrics 2010;125:e214–24.
Bauer K, Laurenz M, Ketteler J, et al. Longitudinal study of energy expenditure in preterm neonates <30 weeks’ gestation during the first three postnatal weeks. J Pediatr 2003;142:390–6.
Verma RP, John E, Fornell L, et al. Body electrolytes in bronchopulmonary dysplasia and the effects of diuretic therapy. Indian J Pediatr 1994;61:213–21.
Atkinson SA, Shah JK, McGee C, et al. Mineral excretion in premature infants receiving various diuretic therapies. J Pediatr 1988;113:540–5.
Edwards HE, Burnham WM. The impact of corticosteroids on the developing animal. Pediatr Res 2001;50:433–40.
Halliday HL. The effect of postnatal steroids on growth and development. J Perinat Med 2001;29:281–5.
Halliday HL, Patterson CC, Halahakoon CWNL, on Behalf of the European Multicenter Steroid Study Group. A Multicenter, Randomized Open Study of Early Corticosteroid Treatment (OSECT) in Preterm Infants With Respiratory Illness: Comparison of Early and Late Treatment and of Dexamethasone and Inhaled Budesonide. Pediatrics 2001;107:232–40.
Hasbargen U, Reber D, Versmold H, et al. Growth and development of children to 4 years of age after repeated antenatal steroid administration. Eur J Pediatr 2001;160:552–5.
Baud O. Postnatal steroid treatment and brain development. Arch Dis Child Fetal Neonatal Ed 2004;89:F96–100.
Babson SG, Bramhall JL. Diet and growth in the premature infant. The effect of different dietary intakes of ash-electrolyte and protein on weight gain and linear growth. J Pediatr 1969;74:890–900.
Fomon S. Size and Growth. In: Fomon S, ed. Nutrition of Normal Infants. 2 ed. St Louis: Mosby, 1993:36–84.
Gibson AT, Pearse RG, Wales JK. Knemometry and the assessment of growth in premature babies. Arch Dis Child 1993;69:498–504.
Griffin IJ, Pang NM, Perring J, et al. Knee-heel length measurement in healthy preterm infants. Arch Dis Child Fetal Neonatal Ed 1999;81:F50–5.
Hermanussen M. Short Term Growth and Mini Growth Spurts. In: Hermanussen M, ed. Auxology: studying human growth and development. Stuttgart, Germany: Schweizerbert Science Publishers, 2013:11.
Lampl M, Veldhuis JD, Johnson ML. Saltation and stasis: a model of human growth. Science 1992;258:801–3.
Florendo KN, Bellflower B, van Zwol A, et al. Growth in preterm infants fed either a partially hydrolyzed whey or an intact casein/whey preterm infant formula. J Perinatol 2009;29:106–11.
Cooke RJ, Griffin I. Altered body composition in preterm infants at hospital discharge. Acta Paediatr 2009;98:1269–73.