Anemia y transfusión en neonatos
Febrero 2016
Anemia y Transfusión en el Neonato
1. Introducción
La anemia neonatal, definida como una concentracion de hemoglobina (Hb)
ó hematocrito (Hct) de > 2 desviaciones estandar por debajo de la media para edad postnatal, es un problema importante encontrado en las unidades de cuidados intensivos neonatales (UCIN). Los recien nacidos son una de las categorias mas transfundidas, con 90% de neonatos de extremo bajo peso al nacer recibiendo al menos una transfusion de glóbulos rojos (RBC) durante su estadía en UCIN. Un bajo nivel de Hb al nacer ha surgido recientemente como un factor de riesgo independiente para la mortalidad y la probabilidad de recibir una transfusion de sangre en recien nacidos prematuros nacidos con < 32 semanas de gestacion, independientemente del tipo de parto y momento de pinzamiento del cordon umbilical. Además , la anemia largo plazo tiene el potencial de afectar tanto el crecimiento del cerebro y otros componentes de enfermedad cronica tanto del RN prematuro como de término.La interpretacion de las anomalias hematologicas en el recien nacido es confundida por la interaccion de
factores genéticos, enfermedad adquirida y factores maternos con las peculiaridades de los eritrocitos fetales. Por lo tanto, el enfoque de los recien nacidos con anemia debe tener en cuenta las caracteristicas especificas de la eritropoyesis del recien nacido, la edad gestacional, las diferentes causas de anemia en RN de término y pretérmino, sus condiciones clinicas, y el riesgo - beneficio de cada opción de tratamiento disponible.Mientras que el manejo de la anemia en recien nacido a termino se ha mantenido practicamente igual en la ultima decada, en los últimos años se ha visto el desarrollo de varios estudios clinicos para informar la práctica basada en la evidencia para diagnostico y tratamiento de anemia en el prematuro, incluyendo transfusion de globulos rojos, agentes estimulantes de eritropoyesis y la práctica estandar. Varias guías nacionales y muchas guías consensuadas a nivel local ham sido implementadas y están actualmente disponibles para guiar la practica de transfusion de los clinicos, pero todavia existen muchas incertidumbres, incluyendo aquellas relativas a los resultados a corto y largo plazo.
2.- Eritropoiesis en feto y neonato
La hematopoyesis en el feto y recien nacido est
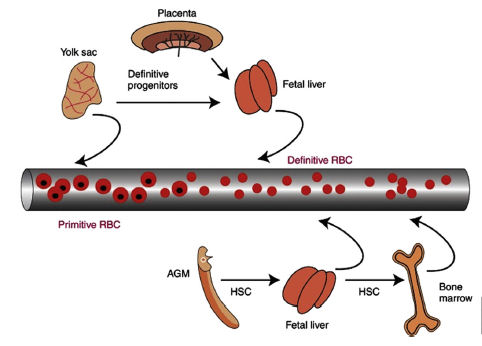
á en un constante estado de cambio y evolucion a medida que el recien nacido se adapta a un nuevo entorno. La Eritropoyesis fetal se produce de forma secuencial durante el desarrollo embrionario en tres sitios diferentes : saco vitelino, el higado y médula osea. La formacion de glóbulos rojos en saco vitelino es máxima entre 2 y 10 semanas de gestacion. La produccion de glóbulos rojos en médula osea comienza alrededor de la semana 18, y por la 30a semana de vida fetal, la médula osea es el organo eritropoyetico principal. Al nacer, en recien nacidos a termino, casi todos los globulos rojos se producen en médula osea, aunque un bajo nivel de eritropoyesis hepatica persiste en los primeros dias de vida (Figura 1).La Eritropoyesis fetal es independiente de la madre. Se observa un rol cada vez mayor para la eritropoyetina (EPO) durante las fases hepatica y médula osea de la eritropoyesis, el higado es el candidato mas probable para producción de EPO durante la vida fetal. El desarrollo de la hematopoyesis in utero y al nacer es controlada por el efecto de varios factores de crecimiento sobre la proliferacion celular y la activacion de genes especificos de celulas. Cada vez más la evidencia muestra que una anomalia en uno de estos genes (ej; GLUT1, GLUT4, KLF) puede causar anemia en el recien nacido.

Figura 1.-
Ontogenia de las células de la línea eritroide en la circulación. Los eritrocitos embrionarios [células rojas primitivas (RBCs)] son fabricados por saco vitelino en día embrionario E7.5 y se encuentran en circulación hasta día embrionario 11 ó 12 (~E11/12) . Al día embrionario 9 ó E9, el saco vitelino y placenta placenta generan progenitores definitivos que migran al hígado fetal, donde se diferencian a RBCs definitivos (expresando hemoglobina fetal / adulta) y entran a la circulación. Al día E10.5, el aortaegonademesonephros (AGM) genera la primera stem cells hematopoiética (HSCs) que migra al hígado fetal y se diferencia a la línea eritroide (entre otras líneas) y estos RBCs definitivos entran a la circulación. Las HSCs del hígado fetal migran y colonizan la médula ósea al nacer , donde suministran a lo largo de la vida producción de RBCs definitos para la circulación. El bazo tambien es sitio de diferenciación para células eritroides (no mostrado).
Box 1
Características del eritrocito neonatal
La vida media de globulos rojos (RBC) al nacer es menor que en adultos : 60 - 70 días (prematuros 35 - 50 dias) en comparacion con 90 - 120 en el adulto, probablemente debido al aumento de la rigidez del RBC.
Los globulos rojos al nacer son mas resistentes a la lisis osmotica, tienen mayor volumen corpuscular medio y concentración más baja de hemoglobina corpuscular media y son más susceptibles al daño oxidativo inducido principalmente debido a una deficiencia en la actividad de la fosfofructoquinasa.
Frotis de sangre periferica : alta frecuencia de dismorfología del RBC en recien nacidos a término (solo 43% tiene forma de disco en comparacion con 78% en adultos y 14% son esferocitos y poiquilocitos versus 3% en adultos) e incluso más en prematuros.
El cambio de hemoglobina desde HbF a HbA ocurre en las primeras semanas despues del nacimiento.
La tasa de síntesis de hemoglobina y la produccion de glóbulos rojos disminuye drasticamente durante los primeros dias despues del parto debido a disminución de EPO (eritropoyetina) en el plasma.
La homeostasis del Hierro es diferente en recien nacidos con niveles más bajos de hepcidina.
Los globulos rojos fetales contienen principalmente Hb fetal,
la cual tiene mayor afinidad por el oxigeno en comparacion con Hb adulta que se produce despues del nacimiento. Hb, Hct y recuento de RBC aumentan durante toda la vida fetal con una tasa de produccion de hematies durante la ultima parte de la vida fetal que quintuplica a la de un adulto normal. Glóbulos rojos extremadamente grandes con un mayor contenido de Hb se producen tempranamente en la vida fetal. El tamaño y contenido de Hb de estas células disminuyen durante la gestación, pero la concentracion de hemoglobina corpuscular media (CHCM) no cambia significativamente. Por lo tanto, los indices de glóbulos rojos y la morfologia al nacer son diferentes de los adultos y se modifican gradualmente hasta alcanzar valores de la infancia varios meses despues del nacimiento. Las distintas caracteristicas de los eritrocitos del recien nacido y su metabolismo (Box 1), tanto en RN a término y pre termino deben tenerse en cuenta al evaluar un recien nacido con anemia.
Se han publicado valores hematológicos de referencia en el recien nacido a termino y prematuro ; ejemplos se muestran en Tabla 1 y Tabla 2.
Tabla 1.- Valores de referencia hematológicos en neonatos a término (Adaptado de Italian National Guidelines) [23].
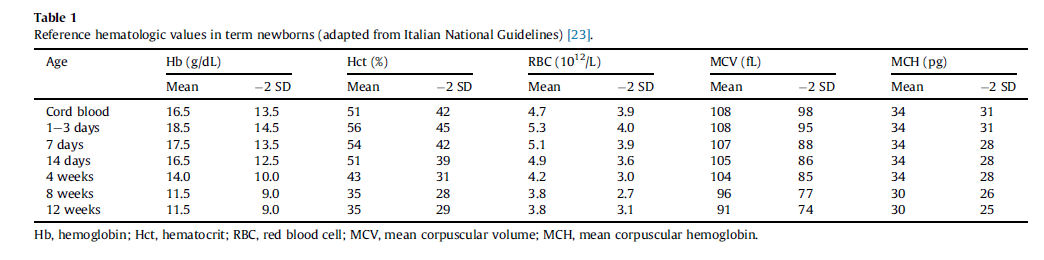
Tabla 2.- Valores de referencia de hemoglobina (Hb) en prematuros (adaptado de Italian National Guidelines) [23].

Debido a la variacion de la poblacion en índices de globulos rojos y variabilidad de las normas en diferentes maquinas automatizadas, muchos centros determinan los valores normativos para su poblacion y muestran valores de referencia en sus sitios web . Los valores mostrados para recien nacidos en paises en vias de desarrollo pueden ser diferentes de las de los paises desarrollados.
Varias variables influyen en lo que puede considerarse valores de referencia para
recien nacidos y durante las primeras semanas de vida. Estas variables incluyen la edad gestacional del recien nacido (termino vs prematuro), tipo de trabajo de parto y tratamiento de los vasos umbilicales (pinzamiento de cordón diferido versus pinzamiento precoz), sitio de muestreo (capilar versus venosa) y momento de muestreo.
3.- Etiopatogenia de anemia en el recién nacido
Al nacer se produce un considerable numero de cambios en la eritropoyesis que son fisiologic
os y que causan en el recien nacido a termino una anemia transitoria llamada anemia fisiologica de la infancia. El prematuro puede presentar una anemia fisiologica exagerada debido a varios factores endogenos y exogenos adyuvantes.La etiologia de la anemia neonatal puede subdividirse en 3 categorias principales : pérdida de sangre, disminucion de produccion y aumento de destruccion de eritrocitos.
3.1. - Anemia fisiológica de la infancia
Cuando los RN inician su primera respiracion, hay considerablemente más oxigeno disponible para union a Hb y la saturación de O2 de la Hb (SaO2) aumenta de ~ 50% a ≥ 95%. El cambio normal en el desarrollo desde síntesis de Hb fetal a Hb adulta reemplaza la alta afinidad por oxígeno de Hb fetal por Hb del adulto con baja baja afinidad por O2, la cual puede entregar ofrecer una mayor fracción de oxigeno unido a Hb a los tejidos. Por lo tanto, despues del nacimiento el aumento del contenido de oxigeno en sangre y entrega de oxigeno a tejidos disminuyen (regulan a la baja) la produccion de eritropoyetina (EPO) de modo que se suprime la eritropoyesis. La concentracion de Hb continúa disminuyendo hasta que las necesidades tisulares de oxigeno son mayores que la entrega de oxigeno. Normalmente, se alcanza este punto entre 6 y 12 semanas de edad, cuando la concentracion de Hb está entre 9,5 y 11 g / dL.
Cuando “hipoxia” es detectada por sensores de oxigenos renales ó hepaticos, la producción de EPO aumenta y la eritropoyesis se reanuda. En el recien nacido a termino el suministro de hierro es suficiente para la sintesis de Hb, incluso en ausencia de ingesta por dieta hasta aproximadamente las 20 semanas de edad. La Anemia fisiologica en recien nacidos a termino sanos es esencialmente benigna, ellos permanecen asintomaticos y no se necesita tratamiento. El Hematocrito nadir en recien nacidos a termino se produce entre 10 y 12 semanas de edad y rara vez cae a < 30% con concentraciones de Hb de 10 - 12 g / dl. Despues de las 10 - 12 semanas, el hematocrito y hemoglobina aumentan lentamente hasta alcanzar valores de los adultos a los 2 años de edad.
3.2.- Anemia de la prematuridad
La anemia de la prematuridad (AOP) es una exageracion de la anemia fisiologica normal y se define como
: anemia en recien nacido prematuro < 32 semanas de gestacion; con recuento de reticulocitos inadecuadamente bajo para la gravedad de la anemia y Concentración de EPO circulante inapropiadamente baja para el grado de anemia. Los prematuros (1200 - 2500 g) alcanzan el punto mas bajo (nadir) más precozmente (5 - 10 versus 6 - 12 semanas) y a menores niveles de Hb (8 - 10 versus 9,5 - 11 g / dL) ó Hct (28 versus > 30%) en comparacion con los recien nacidos a termino; Los prematuros pequenos (< 1.200 g) muestran anemia aún más rápida y más severa (nadir a las 4 - 8 semanas, Hb 6,5 - 9 g / dl, hematocrito 21%).Varios factores endogenos y exogenos contribuyen a la AOP. Entre los primeros están los bajos niveles de EPO en plasma en respuesta a anemia debido a la produccion disminuída de EPO y acelerado catabolismo de la EPO.
Los mecanismos responsables de la produccion de EPO disminuída en prematuros están solo parcialmente definidos. A medida que el feto pasa del ambiente intrauterino hipoxico al medio ambiente postnatal rico en oxigeno, la produccion de EPO es regulada a la baja (downregulated) . Además , despues del nacimiento, la produccion de EPO pasa desde el higado al riñón. Esta transición ocurre durante los primeros 3 - 4 meses post nacimiento a término . Por lo tanto, el sitio principal de produccion de EPO en prematuros se encuentra todavia en higado, en lugar del riñón.
El momento del switch ó cambio desde híigado a riñón se programa en la concepción y no se ve acelerado por el parto prematuro. Este es un importante contribuyente a la AOP debido a que el hígado es menos sensible a la hipoxia tisular como estímulo de producción de EPO que el riñón . Esta disminucion postnatal en la produccion de EPO se traduce en una disminucion del 20% en las celulas progenitoras eritroides en la médula ósea.
El clearance y el volumen de distribucion de la EPO tambien es alto en recien nacidos en relación a adultos y ésto probablemente contribuye a bajas concentraciones circulantes. La velocidad de crecimiento aumentada en comparacion con la de recien nacidos a termino es tambien un factor endogeno que causa AOP.
Los factores exógenos que contribuyen a AOP incluyen: perdida de sangre iatrogenica por exámenes de laboratorio frecuentes, deficiencia de hierro u otras deficiencias nutricionales, inflamación, infecciones y enfermedades cronicas (34).
3.3.- Causas of anemia
Las causas de anemia en el periodo neonatal se enumeran en
Box 2, de acuerdo con las tres categorias principales : perdida de sangre, disminucion de produccion, aumento de destrucción (hemóisis). Solo se consideran los trastornos hereditarios de eritrocitos que causan sintomas neonatales.
Box 2.- Causes of anemia in the newborn period.
a.- Pérdida de sangre oculta antes del nacimiento
Pérdida de sangre
Materno fetal (malformacion ó tumores de placent a, espontanea, etc.)
Transfusion Gemelo a gemelo
b.- Causas obstétricas
Desprendimiento de placenta
Placenta previa
Rotura de un cordon umbilical normal
Ruptura de vasos sanguineos anomalos
Cesarea
Manipulacion intrauterina
Incision de placenta durante la cesarea
c. Hemorragia y sangrado interno en período neonatal
Intracraneal debido a diversas causas (parto rápido, la prematuridad, segundo gemelo, hipoxia, etc.)
Retroperitoneal
Rotura del bazo o del higado
Cefalo hematoma gigante
Hemorragia gastrointestinal
a.- Trastornos hereditarios de glóbulos rojos
- Trastornos de membrana de globulos rojos (esferocitosis, eliptocitosis, etc.)
- Defectos enzimaticos eritrocito (deficiencia de G6PD, deficiencia de piruvato quinasa, etc.)
- Hemoglobinopatias ( a y g talasemias y anormalidades estructurales de la cadena)
b. Inmune
- Incompatibilidad ABO
- Incompatibilidad Rh
- Incompatibilidad de grupos sanguineos menores
- Enfermedades autoinmunes maternas (lupus , anemia hemolitica, etc.)
- Anemia hemolítica inducida por Medicamentos
c. Adquiridas
- Infecciones
- Coagulacion intravascular diseminada
- Anemia micro ó macroangiopatica (estenosis de arteria renal, Hemangioma cavernoso)
- Anemias nutricionales (deficiencia de vitamina E)
Disminucion
de la produccion
Anemia fisiologica de la infancia
Anemia de Diamond Blackfan
Sindrome de Down
Sindrome de Pearson
Osteopetrosis
infecciones inducid
Abreviaciones :
RBC, red blood cell; G6PD,
glucose-6-phosphate dehydrogenase.
4.- Enfoque diagnóstico del R. Nacido con anemia
En vista del gran numero de entidades que pueden ser responsables de anemia en el recien nacido, es necesario un enfoque disciplinado para el diagnostico. El enfoque de diagnostico en caso sospechoso de anemia debe incluir lo siguiente :
4.1. Antecedentes familiares y maternos
La historia familiar es importante para investigar por enfermedades geneticas que causan anemia (ej; esferocitosis, anemias congenitas diseritropoyeticas, glucosa-6-fosfato deshidrogenasa) y se deben incluir preguntas sobre ictericia, calculos biliares, esplenomegalia, antecedentes de transfusiones ó suplementos de hierro en la familia. La historia materna debe poner de relieve las condiciones medicas previas al embarazo (ej; trastornos autoinmunes) ó del periodo ante parto (estado nutricional de la madre y valores hematologicos).
4.2. Antecedentes obstétricos
Esto incluye crecimiento fetal, infecciones virales congenitas, metodo de parto, evidencia de sufrimiento fetal, patologia de la placenta o del cordon umbilical.
4.3.- Examen físico
El examen fisico puede proporcionar una informacion valiosa sobre la causa de la anemia y debe considerar signos de anemia cronica (palidez, falta de aumento de peso, etc.) y signos de
anemia aguda (taquicardia, insuficiencia cardiaca, insuficiencia respiratoria, etc.), signos de la enfermedad congenita en la cual la anemia puede ser parte del cuadro clinico (ej; malformaciones en anemia de Fanconi) ó signos de hemolisis (ictericia, esplenomegalia, cefalo-hematoma, anasarca, etc.).
4.4.- Investigaciones de Laboratorio
Est
as deben incluir, en primer lugar, un hemograma completo para establecer un diagnostico de la anemia. La Hb ó Hematocrito del recien nacido deben ser evaluados de acuerdo a valores de referencia apropiados para edad gestacional y sitio de muestreo (ver Box 1 y Tabla 1 y Tabla 2).Sucesivamente, reticulocitos, índices de globulos rojos, frotis de sangre periferica, indices de hemolisis (bilirrubina total e indirecta, lactato deshidrogenasa, Test de Coombs directo e indirecto) pueden llevarse a cabo de una manera escalonada. Una interpretacion práctica de los parametros hematologicos que puede ayudar en el diagnostico de anemia neonatal se muestra en Figura 2.
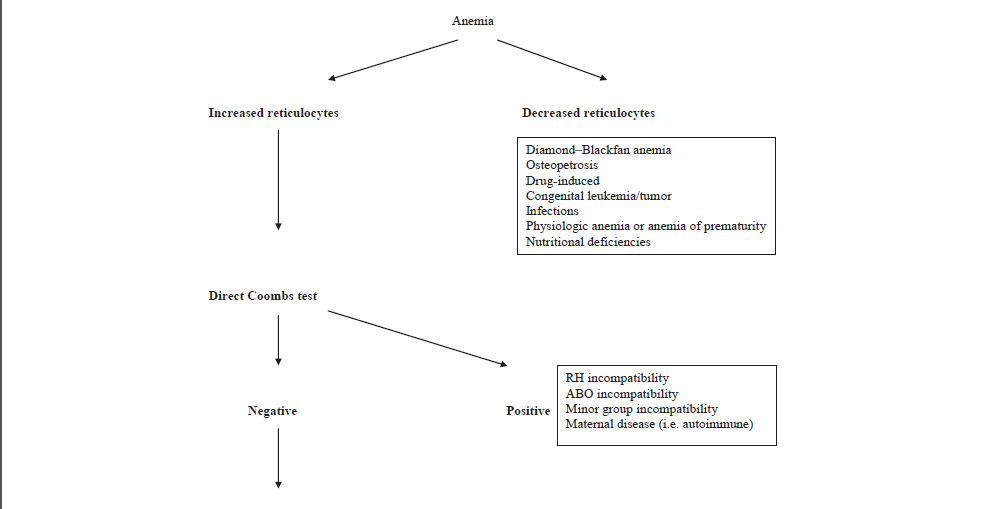
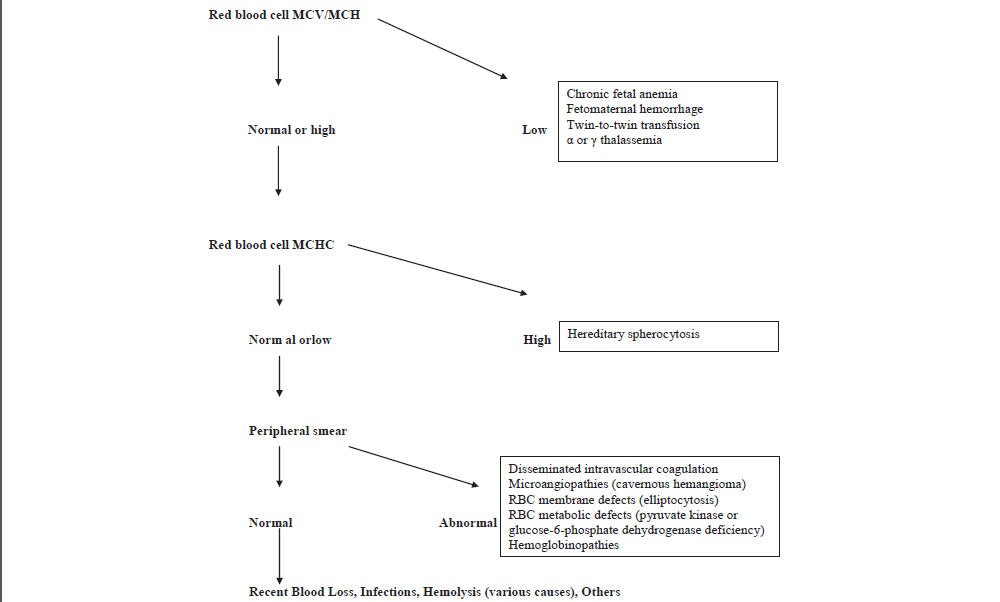
Figura 2.- Enfoque diagnostico para Anemia Neonatal basado en Indices hematológicos. MCV: volumen corpuscular medio; MCH: hemoglobina corpuscular media
5.- Tratamiento de la anemia
5.1.- Transfusión de
glóbulos rojos
El tratamiento de la
anemia tiene
como
objetivo
mantener el suministro de
oxígeno adecuado a los tejidos.
La transfusion tiene una clara indicacion en caso de perdida de
sangre
ó shock para restauracion del volumen sanguineo. En el resto de
situaciones, tanto en recien
nacidos a
termino y pre termino, las guias de transfusion publicadas hasta la fecha
se basan, principalmente, en opinion de expertos.
En
ausencia de buena evidencia de criterio
definitivos
para transfusion, incluyendo
cuando
transfundir,
se sugiere
que la decision
para
transfundir debe tomar en consideración
una
combinacion de signos clinicos y
parametros de laboratorio, teniendo en cuenta el estado de salud y las necesidades fisiologicas
del
niño. Muchas instituciones han adoptado
protocolos con el fin de estandarizar las
practicas de
transfusion y
ayudar a los médicos en la decision
de transfundir prematuros y recien nacidos a termino, utilizando una combinacion
de signos clinicos y parametros
de
laboratorio.
Se dan ejemplos
de guias de transfusion para los
recien nacidos a termino y pre termino
en
Box
3
y Box
4 y en Tabla 3.
Los Productos
de transfusión (32,35) para transfusiones neonatales deben estar sin leucocitos, irradiados para RN con peso < 1.200 g (incluso algunos centros utilizan eritrocitos irradiados para toda transfusion neonatal) y desde donantes seleccionados para limitar la exposicion a donantes. Las guías nacionales deben de describen las caracteristicas que deben tener los globulos rojos transfundidos (17-23).
Box 3.- Ejemplos de guía de transfusión en neonatos [17 - 21]. Recomendaciones para transfusión de G. Rojos (Canadian 2002; Irlanda 2007) [17 - 21].
Deben considerarse transfusiones de Glóbulos rojos en Neonatos en las siguientes situaciones clínicas específicas :
Shock Hipovolémico asociado con pérdida aguda de sangre
Hematocrito entre 30 y 35% ó concentración de Hb entre 100 y 120 g/L en condiciones de extrema enfermedad para la cual la transfusión de GR puede mejorar la entrega de o2 a órganos vitales.
Hematocrito entre 20% y 30% ó concentración de Hb entre 60 y 100 g/L, y RN severamente enfermo y/o en ventilación mecánica con entrega de oxígeno comprometida.
Hematocrito en disminución (20%) ó concentración de Hb (60 g/L) con Recuento de reticulocito ≤ 100.000 - 150.000 / mm3 (sugiriendo baja concentración plasmática de eritropoyetina) y si están presentes los siguientes clínicos : fretraso de crecimiento ó no ganancia de peso , taquicardia > 180 lpm, signos respiratorios incluyendo taquipnea y requerimiento de oxígeno suplementario y letargia [12,51]
Guías para Transfusión de glóbulos rojos en pacientes < 4 meses (USA 2000; Irlanda 2007) [18,21]
Hct < 20% con bajo recuento de reticulocitos y síntomas de anemia (taquicardia, taquipnea, inapetencia)
Hct < 30% con neonato :
En < 35% O2 en hood
En O2 por cánula nasal
En presión positiva continua de vía aérea y/o ventilación mandatoria intermitente con ventilación mecánica con presión media de vía aérea (PMVA) < 6 cmH2O
Con apnea ó bradicardia significativa a
Con taquicardia ó taquipnea significativa b
Con baja ganancia de peso c
Hct < 35% con neonato :
En > 35% O2 Hood
En presión positiva continua de vía aérea / ventilación mandatoria intermitente con PMVA ≥ 6 - 8 cmH2O
Hct < 45% con un RN :
En oxigenacion por membrana extracorporea
Con cardiopatía congenita cianotica
a Más de 6 episodios en 12 h ó 2 episodios en 24 h requiriendo ventilación bolsa - máscara cuando están recibiendo dosis terapéutica de metilxantinas.
b FC >180 lpm por 24 h; FR > 80 respiraciones / minuto por 24 h.
c Ganancia de < 10 g/día observada en 4 días mientras reciben 100 kcal/kg/día.
Umbrales sugeridos de transfusión para niños < 4 meses (UK, 2004) [19,20]
Anemia en las primeras 24 h: Hb 12 g/dL (Hct ~0.36)
Pérdida de sangre acumulada en 1 semana (muestras sanguineas), recien nacido que requiere cuidados intensivos : 10 % del volumen sanguíneo
Neonato recibiendo cuidado intensivo : Hb 12 g/dL
Pérdida aguda de sangre : 10%
Dependencia crónica de oxígeno : Hb 11 g/dL
Anemia tardía, paciente estable : Hb 7 g/dL
Box 4.- Guias de transfusion de glóbulos rojos alogénicos (indicaciones y umbrales) para Anemia del prematuro
Transfundir para mantener el hematocrito por cada situacion clinica:
Fi02 > 40% (35-45%a ) para enfermedad cardiopulmonar severa
Fi02 > 30% para enfermedad cardiopulmonar moderada
Fi02 > 30% para cirugia mayor
Fi02 > 25% (20-25%a) para anemia sintomática
Fi02 > 20% para anemia asintomatica
- a Refleja prácticas que varian entre los neonatologos. Por tanto, cualquier valor dentro del rango es aceptable para las practicas locales.

5.1.1.- Temas abiertos en
transfusión de prematuros
Varios asuntos permanecen abiertos en relacion con el umbral optimo para transfusi
ón (alto versus bajo), efectos secundarios y consecuencias a corto y largo plazo de la transfusion.Cuatro estudios investigaron umbral bajo de Hb ó Hct versus umbral alto de Hb ó Hct (diferencia promedio de 2 g / dl para Hb) en la transfusion para prevenir la mortalidad y la morbilidad del neonato de muy bajo peso al nacer (MBPN) y fueron incluídos en una reciente revision Cochrane. No se observaron diferencias en la sobrevida, complicaciones a corto plazo tales como enterocolitis necrotizante (NEC), retinopatia del prematuro (ROP), displasia broncopulmonar (DBP) ó resultado neurologico a los 18 - 22 meses, lo que demuestra que no hay beneficio claro ó riesgo atribuible al uso de umbrales de transfusion de HB bajos versus altos de hemoglobina en neonatos de muy bajo peso al nacer. Las observaciones de analisis post hoc en el estudio " Premature Infants in Need of Transfusion (PINT) " sugieren outcomes ó resultados más pobres en el Neurodesarrollo y en el alta hospitalaria en los grupos de umbral bajo y hacen que sea dificil rechazar una conclusion de que la utilizacion de un umbral alto puede ser beneficioso.
La recomendacion de los autores de la revision Cochrane es por lo tanto no exceder los niveles mas altos de Hb utilizadas en estos estudios y por lo tanto disminuir los riesgos de sobretransfusión, pero no se debe permitir que el nivel de Hb caiga bajo los limites inferiores testeados en estos estudios hasta que se completen más estudios. La displasia broncopulmonar, retinopatia del prematuro y NEC involucran daño oxidativo a tejidos inmaduros. Se ha postulado que las transfusiones de eritrocitos adultos contribuyen al riesgo de desarrollar estas morbilidades, como consecuencia de Hb adulto liberando cantidades no fisiológicas de oxigeno a tejidos en desarrollo.
Datos publicados apoyan dos nuevos riesgos potenciales de las transfusiones entre los recien nacidos de Muy bajo peso de nacimiento :
El primero es una asociacion entre transfusiones "tempranas" de globulos rojos y la posterior aparicion de Hemorragia intraventricular grado 3 ó 4 . Aunque el mecanismo fisiopatologico subyacente de esta asociacion aun no se ha demostrado, deben hacerse esfuerzos encaminados a reducir transfusiones precoces de globulos rojos durante los primeros dias despues del parto en prematuros MBPN .
El segundo riesgo reportado es una asociacion entre transfusiones “tardias” de globulos rojos y la posterior aparicion de NEC. En los ultimos anos, la asociacion entre recepcion de una
transfusion de sangre y el desarrollo de NEC dentro de 48 horas siguientes ha sido reconocida cada vez más.El mecanismo patogenico potencial (s) que causan NEC asociada a transfusion incluye las variables para las cuales se ordeno la transfusion (es decir, valor de hematocrito del paciente
a transfundir), mecanismos inmunologicos y propiedades biomecanicas deficienetes de eritrocitos almacenados en bancos. En una revision en 2005 Agwu y Narchi solo encontraron evidencia de baja calidad de que la transfusion de sangre se asocia con desarrollo de NEC en prematuros.Desde entonces, estudios
adicionales, incluyendo una revision sistematica y meta-analisis, han proporcionado evidencia de apoyo adicional (40) . Sin embargo, sigue habiendo importante controversia (42) .Un problema clinico importante es si suspender la alimentacion durante la transfusión puede disminuir el riesgo de NEC en prematuros. El nivel de evidencia de los estudios revisados es bajo y varios estudios sólo están disponibles en forma de abstract. Los estudios observacionales retrospectivos son vulnerables a problemas metodologicos, incluyendo el sesgo de confirmación, evaluacion no cegada, sesgo de publicacion y factores confundentes. Algunos autores sugieren que, dado que el riesgo de la intervencion es bajo y el beneficio potencial sustancial, seria razonable suspender la alimentacion durante la transfusion en espera de evidencia adicional . Sin embargo, no hay acuerdo sobre esta practica.
Por lo tanto, se mantiene la incertidumbre sobre el regimen de transfusion óptimo para prematuros y con suerte, dos estudios en curso ayudarán en ésto.
El estudio "Effects of Transfusion Thresholds on Neurocognitive Outcome of Extremely Low Birth-Weight Infants (ETTNO) " proporcionará datos definitivos sobre la eficacia y seguridad de la transfusion de G. Rojos restrictiva versus la transfusion liberal de globulos rojos en el outcome del neurodesarrollo a largo plazo.
El estudio "Transfusion of Premature Trial (TOP): Does a Liberal Red Blood Cell Transfusion Strategy Improve Neurologically-Intact Survival of Extremely-Low-Birth-Weight Infants as Compared to a Restrictive Strategy ? " evaluará los umbrales de transfusion y secuelas neurologicas.
5.2. EAs (eopoetinas alfa) : eritropoietina, darbepoetina alfa (dapopoietin en inglés)
La EPO ha sido la EA más utilizada probada en recien nacidos con anemia, siendo la justificacion para su uso la disminución transitoria en la producción de EPO en los primeros meses despues del nacimiento. Se esperaba que, mediante la administracion de EPO, la eritropoyesis se reanudaria más rapidamente y la necesidad de transfusion de globulos rojos se
reduciría. Darbepoetin es una EA de larga duracion con la ventaja de un esquema de administracion menos frecuente en comparacion con EPO (15) . En el recien nacido a termino con anemias hemoliticas, es una practica actual en algunos centros administrar EPO a los niños con esferocitosis en el primer año de vida con el fin de reducir el numero de transfusiones. Falta la prueba basada en evidencia para este tratamiento aunque varios estudios han demostrado un claro beneficio del uso de EPO (46-48).
5.2.1.- Temas abiertos para uso de EA en prematuros
No hay evidencia de que las EAs estén indicadas para el tratamiento de anemia en el recien nacido prematuro. Muchos estudios han investigado su rol en la prevencion de la anemia con el fin de reducir el numero de transfusiones, tan pronto (antes de 8 días de vida) ó más tardía (despues de 8 días).
La administracion temprana de EPO reduce el uso de una ó más transfusiones de globulos rojos, el volumen de globulos rojos transfundidos y el numero de donantes y transfusiones a que neonato está expuesto, pero estas disminuciones son de importancia clinica limitada y se acompañan de un aumento significativo de ROP. EPO no reduce ni aumenta significativamente ningún outcome ó resultado adverso importantes incluyendo mortalidad, hemorragia intraventricular y NEC. Por lo tanto, los autores de la revision Cochrane concluyen que la EPO no debe utilizarse rutinariamente. Sin embargo, el uso de EPO ó darbopoietin-alfa muestra outcomes neuro cognitivos mejorados a largo plazo [50].
La administracion tardia de EPO reduce el uso de una ó más transfusiones de globulos rojos, el número de transfusiones de globulos rojos por neonato (< 1 transfusión por neonato), pero no el volumen total (ml / kg) de glóbulos rojos transfundidos por recien nacido. Alguna exposición a donante es probablemente no evitada dado que la mayoria de los estudios incluyeron neonatos que habian recibido transfusiones de globulos rojos antes del ingreso al estudio . El uso tardio de EPO no reduce ni aumenta significativamente los outcomes adversos clinicamente importantes a excepcion de una tendencia en aumento del riesgo de retinopatia del prematuro. Los autores concluyen que éste ya no debe ser un campo de investigacion.
6. Prevención de anemia
6.1. Prematuro
El mantenimiento de un hematocrito
/ Hb más alto tiene el objetivo de evitar las transfusiones y por lo tanto los posibles riesgos de la transfusion al mismo tiempo que permite una buena oxigenación tisular y desarrollo del órgano.Las estrategias para reducir las transfusiones, probadas durante los ultimos 15 anos, incluyen :
Prácticas en sala de partos : prácticas de bajo costo que se pueden implementar en sala de partos para disminuir la necesidad de transfusiones durante los primeros dias despues del nacimiento : pinzamiento del cordón umbilical retrasado, ordeñamiento del cordón umbilical y toma de todas las muestras basales de laboratorio UCIN desde sangre fetal en la placenta.
Medidas para reducir la pérdida de sangre: limitar perdidas por flebotomia para exámenes de sangre; devolver el volumen de espacio muerto despues de tomar muestra desde un cateter arterial; procedimientos de laboratorio con Micro técnica y desarrollo de metodos de monitorizacion no invasiva que permitan la disminución de analisis repetidos de gases en sangre y otras pruebas de laboratorio.
Adopción de guias de transfusion y criterios de transfusión adaptados localmente.
Formulas enriquecidas con hierro. Más hierro que la formula fortificada no parece ser necesario (9)..
EA: EPO o darbepoetin. La administracion temprana podria ser considerada en circunstancias seleccionadas, pero no debe ser recomendado rutinariamente (50).
Puntos prácticos
No hay un solo indicador clinico o de laboratorio único que defina la necesidad de transfusión de sangre, sino una combinacion de factores.
Adopcion de guías y criterios de transfusión mejora las estrategias de transfusion.
Se mantiene la incertidumbre sobre el momento preciso y base para Transfusión
Direcciones de la investigación
Evaluacion de la interaccion entre anemia, intestinos crónicamente hipóxemicos / hipoperfundidos y terapia temprana de hierro u otros enfoques farmacologicos para la prevencion / tratamiento de anemia y transfusiones de glóbulos rojos.
Identificar los biomarcadores adecuados o convenientes para transfusión de globulos rojos.
Beneficios de EPO temprana versus riesgos todavia necesitan ser investigados .
Umbrales de transfusion y efectos a largo plazo.