Ventilación de
prematuros durante clampeo retrasado de cordón umbilical
Junio
2016
Ventilación de prematuros durante
clampeo retrasado de cordón umbilical (VentFirst): estudio piloto de
viabilidad y seguridad
Jameel Winter, MD y Cols
American Journal of Perinatology 2016
Traducción libre : Dr
Gerardo Flores Henríquez
Pediatra Neonatólogo
Puerto Montt Chile
Muchas de las principales complicaciones
experimentadas por los prematuros pueden tener orígenes inmediatamente después
del nacimiento, en la transición desde la vida intrauterina a la vida
extrauterina. Este es un período crítico marcado por cambios cardiopulmonares
importantes dado que el niño se separa de la placenta y hace una transición
desde respiración y circulación fetal a neonatal.1 Los neonatos
muy prematuros tienen microvasculatura cerebral frágil y reflejos
cardiovasculares inmaduros, lo que hace que sean menos capaces de compensar las
fluctuaciones de frecuencia cardíaca (FC) y presión arterial y aumenta su riesgo
de isquemia cerebral y hemorragia intraventricular (HIV). 2
El momento del pinzamiento del cordón umbilical ha cambiado considerablemente a
lo largo de los siglos, con recomendaciones que van desde el pinzamiento
inmediato del cordón de sujeción para retrasar hasta clampeo retrasado hasta que
las pulsaciones cesen. 3-5 Con el advenimiento de las
subespecialidades de perinatología y neonatología en la mitad del siglo 20,
entró en práctica el pinzamiento inmediato del cordón umbilical para permitir el
manejo activo de la tercera etapa del parto para disminuir el riesgo de
hemorragia materna 6 y para facilitar el acceso inmediato del equipo
de reanimación neonatal al neonato.7
En el siglo 21, ha habido un resurgimiento
de recomendaciones para retrasar el clampeo del cordón umbilical.8 Una
revisión Cochrane 2012
de 15 estudios de clampeo retrasado de cordón (CRC) en
recién nacidos prematuros demostró beneficios, incluyendo aumento de
hematocrito, presión arterial más estable, menos necesidad de transfusión de
sangre ó de soporte de presión arterial y tasa levemente disnuída de HIV.9
Basado, en parte, en estos estudios, el Colegio americano de Obstetricia y
Ginecología en 2012 elaboró una guía de práctica clínica apoyando 30 a 60 segundos de
retraso en el pinzamiento del cordón umbilical después de un parto pretérmino
cuando fuese factible. 10
Una cuestión clave en la factibilidad de
CRC
en los recién nacidos prematuros es la percepción de que la ausencia de esfuerzo
respiratorio requiere de intervención inmediata por parte del equipo neonatal, de
ahí la necesidad de la separación de la placenta.11 De hecho, hay
cada vez mayor evidencia que sugiere que son precisamente éstos prematuros apneicos quienes
se beneficiarían más de CRC si la ventilación puede ser estimulada ó asistida. Los
estudios realizados en corderos sugieren que el inicio de la ventilación antes
de la ligadura del cordón es el componente clave de una transición estable al
nacimiento.12-14 En estos estudios, corderos prematuros que fueron sometidos a
clampeo precoz de
cordón seguido de ventilación asistida tenían marcadas
fluctuaciones en la frecuencia cardíaca, gasto cardíaco y oxigenación cerebral y
oxigenación arterial y aquellos ventilados antes del clampeo tenían una
transición cardiovasculares mucho más suave.
Cabe destacar que en los corderos cuyos
cordones umbilicales fueron clampeados antes del inicio de la ventilación, el
flujo sanguíneo cerebral (FSC) casi se duplicó con un retorno gradual a la línea
de base al inicio de la ventilación. Este aumento dramático en el flujo
sanguíneo cerebral no se
observó en los corderos que recibieron ventilación asistida antes del
pinzamiento del cordón. Se ha postulado que la frágil microvasculatura cerebral
de los prematuros extremos acoplada con grandes oscilaciones en la presión
arterial y flujo sanguíneo son en gran medida responsables de la alta incidencia
de hemorragia intraventricular en neonatos de extremo bajo peso de nacimiento.13,15
El propósito de este estudio es evaluar la
viabilidad y la seguridad de asistir la ventilación de recién nacidos muy
prematuros antes de pinzar el cordón umbilical. Si se prueba que la técnica es
factible y segura, un estudio controlado randomizado multicéntrico sería esencial
para evaluar el impacto de este enfoque en los outcomes clínicos.
Métodos
Diseño del Protocolo
En el desarrollo del protocolo "VentFirst" mediante el cual los recién nacidos prematuros podrían recibir ventilación
asistida durante 90 segundos de clampeo retrasado de cordón nos enfrentamos a varios problemas
logísticos :
-
Hacinamiento: El área de parto para un
neonato de alto riesgo en un hospital docente está a menudo lleno de
personal y equipo y puede haber un espacio limitado inmediatamente adyacente
a la madre en el momento del nacimiento. La longitd promedio del cordón
umbilical a las 24 a 32 semanas es de 30 a 40 cm, lo que exige que equipo
neonatal trabaje en estrecha proximidad a la madre.16,17
En la planificación de la intervención, los autores del presente estudio trabajaron estrechamente con el
obstetra (OB) y el equipo neonatal para asegurar un posicionamiento óptimo para
proporcionar soporte ventilatorio durante el clampeo retrasado de cordón sin comprometer
la seguridad. Los autores utilizaron un
enfoque de 2 neonatólogos para la atención inmediata. Inmediatamente después
de que el neonato salió del útero, el equipo obstétrico cedió espacio al equipo neonatal
para los 90 segundos de intervención, pero los obstetras se mantuvieron muy
cerca de la incisión en caso de parto por cesárea y del introito en partos
vaginales (Figura 1) .
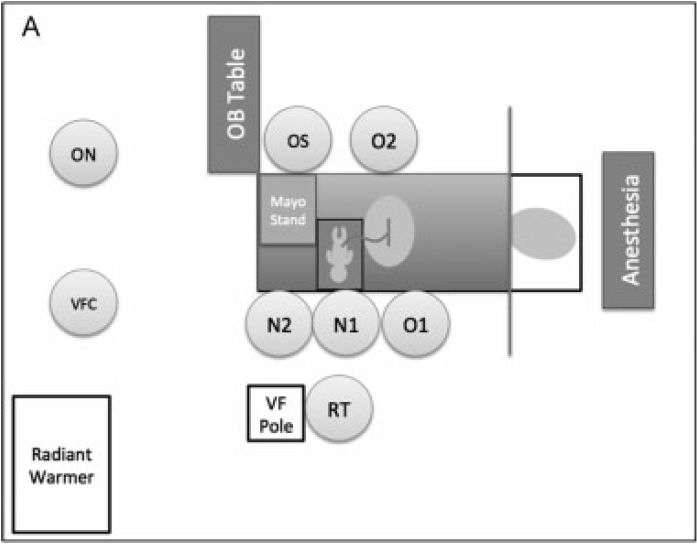
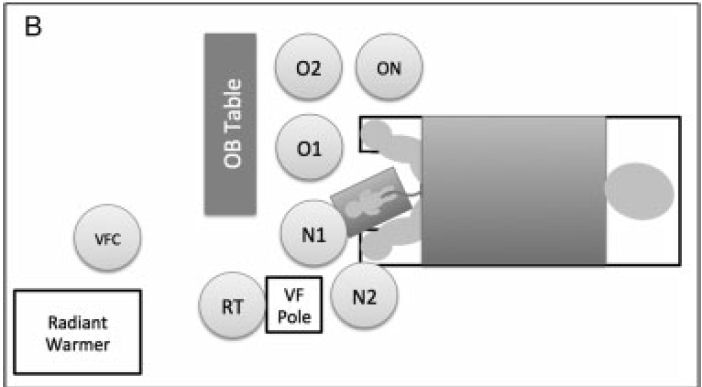
Figura 1.-
Disposición de personal y equipo para
proporcionar asistencia ventilatoria durante el pinzamiento tardío del cordón
umbilical. (A) VentFirst equipos y personal en partos por cesárea. (B) VentFirst equipos y personal
en partos vaginales. VFC: VentFirst lector de
coordinador / script; O1: obstetra principal O2: obstetra secundario; ON:
Matrona OS: OB técnico de matorrales; N1: neonatólogo a cargo de
vías respiratorias; N2: neonatólogo a cargo de pasos iniciales y
evaluación de frecuencia cardíaca ; RT: terapeuta respiratorio. VFC:
Coordinador VentFirst OS: Técnico obstetricia
-
Equipo de reanimación, superficie
estable para la reanimación y termorregulación: los autores prepararon un "VentFirst
Pole" sobre ruedas, sobre el cual se montaron una pieza en T de rean
imación (Neopuf) ,
cilindros de oxígeno y aire, blender (mezclador) y flujómetro. Para los partos
vaginales, se utilizó una mesa estable sobre ruedas avanzada hacia el introito
inmediatamente después del parto (Figura 2)
. Para los partos por cesárea,
se coloca al neonato sobre la pelvis ó muslos de la madre dependiendo de la
longitud del cordón. En ambos casos (partos vaginales y quirúrgicos) el neonato se colocó
sobre una almohadilla de calentamiento con gel químico y se envolvió con una lámina
ó bolsa de
polietileno estéril para evitar la pérdida de calor durante la intervención.
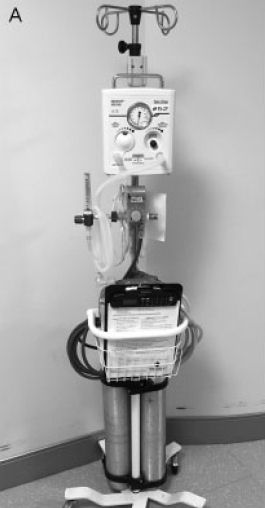
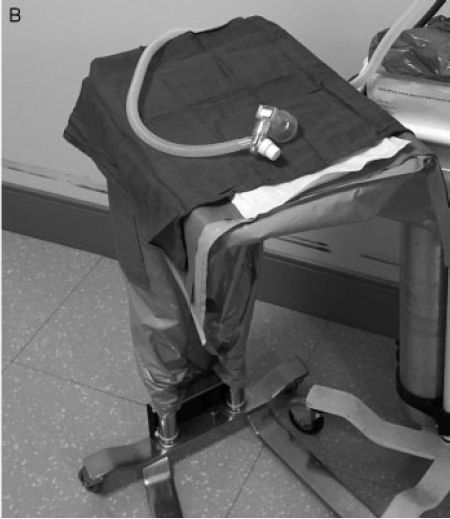
Figura 2.- Equipo VentFirst. (A)
Equipo VentFirst sobre ruedas: equipo montado (de arriba a abajo) incluye
resucitador de pieza en T, mezclador de oxígeno y flujómetro, cesta para los
suministros de reanimación y cilindros de aire y oxígeno. (B) Tabla de VentFirst
en los partos vaginales. Esta es una mesa estable con altura ajustable y sistema
de rueda / freno. Sobre la mesa está una "plataforma de calentamiento VentFirst"
que consta de tres capas (de abajo a arriba): una almohadilla térmica química,
Paños de sala de operaciones y lámina de polietileno (no se muestra). Para
los partos vaginales, la mesa se acerca hacia el introito vaginal
inmediatamente después del parto y se coloca al neonato en la base de calentamiento.
En un parto por cesárea, la tabla no se utiliza; la almohadilla de calentamiento
se coloca directamente en la pelvis de la madre y se utiliza como
plataforma de reanimación. Observe que la tabla VentFirst vaginal sólo
se utiliza para la estabilización del neonato durante el pinzamiento del cordón
retardada y no para transporte del RN.
Educación con simulación
Los autores utilizaron vídeos de la configuración del
equipo y simularon partos por cesárea y vaginal para entrenar a los
miembros del equipo neonatal y obstétrico. Se entrenó a un "Coordinador VentFirst"
que está presente en todos los partos del estudio para asegurar la
propiada colocación del equipamiento , asignar y revisar los roles de los
miembros del equipo, el momento y tiempo de la intervención y leer un guión preparado
para asegurar que las pasos adecuados se realizaron en los momentos correctos.
Grabamos en vídeo varios partos VentFirst para educación y revisión de
la calidad.
Criterios de inclusión y exclusión y Consentimiento
Este estudio fue aprobado por la
Junta de Revisión Institucional de la Facultad de Medicina de la Universidad de
Virginia. Mujeres embarazadas ingresadas en Unidad de Prepartos y
Partos en espera que se produzca parto entre las 24 0/7 y 32 6/7 semanas de
gestación fueron seleccionadas para la
participación.
Las exclusiones incluyeron condiciones
conocidas que amenazan la vida fetal, embarazo gemelar monocoriónico ó monoamniótico, múltiples superiores a
gemelos y desprendimiento de la placenta. Se solicitó a las madres sin exclusión consentimiento informado
por escrito. Los neonatos cuyas madres firmaron el consentimiento
fueron sometidos al protocolo si el parto se producía entre las 24 0/7 y 32 6/7 semanas de gestación, siempre que hubiese tiempo
suficiente para que el equipo preparara la intervención VentFirst.
Protocolo
Cuando el parto con VentFirst era inminente,
el Coordinador , usando un checklist ó lista de control se aseguró que el
equipamiento y los miembros del equipo estaban preparados y entendían sus roles. Dos
neonatólogos con experiencia en reanimación del prematuro (preparados en forma
estéril para partos quirúrgicos) atendieron al recién
nacido durante los 90 segundos del protocolo y un terapeuta respiratorio se
hizo cargo del equipo de "VentFirst" con el equipo de reanimación. El
Coordinador activa un timer ó contador de tiempo al nacer, leyó un guión preparado y registró
los datos. Inmediatamente después del nacimiento, el RN fue colocado en la
plataforma de calentamiento, la boca y nariz fueron succionadas si era
necesario y al niño se le dió gentil estimulación táctil para que respirara y le
envolvió en una lámina de polietileno. A los 30 segundos, el neonatólogo evaluó
si el neonato respiraba bien o no. El respirar bien incluye el llanto u
otra prueba de respiración espontánea. No respirar bien incluyó
apnea ó gasping (jadeo).
Si estaba respirando bien, se administró presión
positiva continua de vía aérea (CPAP) y si no estaba respirando bien se le dió ventilación
a presión positiva intermitente (VPP) de acuerdo con las guías del Programa de Reanimación
Neonatal (NRP) y con el protocolo de la unidad de los autores (CPAP ó presión
positiva al final de espiración : 6 cm H2O; PIP: 20 - 25 cm H2O; FiO2 = 0,30). Si el
status respiratorio de un RN cambiaba durante los 90 segundos de intervención,
el modo de ventilación asistida podía ser cambiado en consecuencia. Un detector
de CO2 espirado colorimétrico se utilizó para evaluar la ventilación y la Frecuencia Cardíaca
se
evaluó a los 60 segundos por suave palpación del cordón. A los 90 segundos, el
cordón umbilical fué clampeado y cortado y el RN llevado al área de reanimación
donde continuó la reanimación según PRN (programa de reanimación neonatal) y las
guías de la unidad.
Es de destacar que los equipos obstétrico
y neonatal fueron instruídos que podían abandonar el procedimiento en
cualquier momento si había preocupaciones acerca del binestar de la madre ó del
neonato.
Después de cada parto VentFirst, los miembros del equipo neonatal y obstétrico
analizaron cualquier preocupación ("debriefed" ) y todas las sugerencias se
consideraron para futuros partos VentFirst.
Outcomes
Los datos maternos extraídos de la
historia clínica incluyeron las complicaciones del embarazo, trabajo de parto ó
parto, el modo de parto y, si el parto era por cesárea si hubo infección uterina
posparto ó infección de herida operatoria. Los datos neonatales recogidos incluyen edad
gestacional (EG), peso al nacer, score de Apgar, gases de sangre del
cordón umbilical y temperatura de ingreso a UCIN.
Resultados
Enrolamiento
Entre agosto de 2014 y junio de 2015, 75
mujeres que tuvieron su parto con < 33 semanas EG fueron abordadas por
el consentimiento. Un total de 52 consintió para la participación en el estudio y
el protocolo se llevó a cabo en 28 partos : 29 recién nacidos incluyendo
un conjunto de gemelos (Table 1). Las restantes 24 mujeres
que dieron su
consentimiento no se sometieron al protocolo ya sea porque tuvieron su parto a las 33
semanas (15 casos), fueron partos precipitados sin tiempo suficiente para la
configuración del equipo (siete casos) ó debido a preocupaciones no
específicos de los clínicos (2 casos).
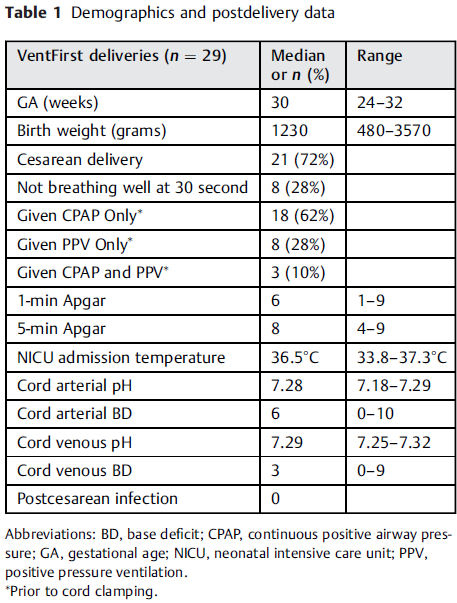
Factibilidad
En los 28 partos (29 recién nacidos), se
llevó a cabo el protocolo completo de 90 segundos. De los 29 recién nacidos, 21
(72%) neonatos nacieron por cesárea y en todos los casos, el posicionamiento
del RN sobre la cubierta térmica de colchón colocado sobre la pelvis de la madre
permitió un acceso adecuado del equipo neonatal al bebé.
Los partos
vaginales demostraron mayor desafío. Inicialmente los autores colocaron al
RN en
una estructura de soporte sobre la cadera de la madre, pero encontraron difícil
esta posición
debido a la corta longitud del cordón umbilical. Posteriormente trasladaron
el soporte y lo colocaron cerca del introito inmediatamente después del parto,
moviéndose
el obstetra hacia el lado lado y colocando al RN en el soporte para que el neonatólogo diera asistencia ventilatoria hasta que el cordón
fuese clampeado a los 90 segundos. En ambos casos, partos por cesárea y vaginal, después de que
el cordón fué clampeado, el RN fue llevado a la mesa de reanimación neonatal
donde continuó la reanimación estándar.
Seguridad
Las medianas de los scores de Apgar fueron
6 y 8 a los 1 y 5 minutos, respectivamente y los pH de sangre del cordón
umbilical no demostraron acidosis significativa (Tabla 1).
El promedio de temperatura al ingreso a UCIN fue 36,5 ° C (rango intercuartil: 36.2 a 36.9
° C). 4 (18%) niños tenían hipotermia clínicamente significativa (< 36 ° C).
2 de estos niños fueron sometidos a reanimación en una amplia sala de partos
después de la intervención VentFirst. Esto fue similar a la tasa de
hipotermia al ingreso a UCIN en la Unidad de los autores durante el período de tiempo del
estudio para neonatos < 33 semanas de gestación.
No hubo infecciones documentadas postcesárea entre las madres enroladas durante su hospitalización después del
parto y no hubo infecciones en el seguimiento después del alta hospitalaria. Hubo una
violación del protocolo en la cual se enroló un RN con hidrops fetal. El neonato toleró el protocolo experimental
pero murió más tarde debido a
complicaciones del síndrome nefrótico congénito.
Discusión
A pesar de la creciente evidencia de que
un retraso en el clampeo del cordón umbilical es beneficioso para los recién
nacidos prematuros, 9,10,18 muchos centros siguen realizando pinzamiento
inmediato del cordón para evitar un retraso en la reanimación, en particular
para los niños que no están vigorosos al nacer. 19,20
Dos estudios de recién
nacidos prematuros que se sometieron a clampeo retrasado de cordón demostraron que
aquellos que no respiran antes
de que el cordón esté clampeado tienen outcomes peores, 21,22 y la
evidencia de modelos
preclínicos sugiere que la inflación pulmonar antes de la ligadura del cordón
es fundamental (crítica) para reducir las oscilaciones de la presión
sanguínea cerebral y de la presión arterial
sistémica que podrían causar isquemia ó hemorrgia.13,14
En el presente pequeño
estudio piloto de 29 recién nacidos, se encontró que asistir la ventilación de
los recién nacidos muy prematuros < 33 semanas de gestación mientras están
unidos a la placenta es factible y seguro.
Fisiología transicional
Para entender la importancia de establecer
la respiración antes del pinzamiento del cordón, debe ser considerada la fisiología de
la transición. Al nacer , cuando los pulmones se inflan y la presión
parcial de oxígeno aumenta, cae la resistencia vascular pulmonar y
el débito
del ventrículo derecho se dirige hacia los pulmones. El aumento en el flujo sanguíneo pulmonar
causa aumento de retorno de la sangre
oxigenada a la aurícula izquierda. El aumento de la presión de la aurícula
izquierda cierra el foramen oval y aumenta el débito de ventrículo izquierdo ,
estabilizando así la presión arterial sistémica.
Esto causa una transición normal desde circulación fetal a circulación
neonatal sin fluctuaciones significativas en el flujo sanguíneo cerebral.12 Por el contrario, cuando
el cordón es clampeado ó pinzado antes del inicio de la respiración, lo cual sucede a
menudo cuando los neonatos nacen prematuros extremos, la siguiente fisiología
adversa ocurre : baja precarga cardíaca (vena umbilical clampeada), aumento de
postcarga cardíaca (arterias umbilicales clampeadas), mantenimiento de
elevada resistencia vascular pulmonar y persistencia de shunt derecha a
izquierda auricular y ductal.
Los estudios en corderos prematuros
demuestran que el pinzamiento del cordón antes de la ventilación se asocia con
grandes fluctuaciones en la presión sanguínea cerebral y flujo sanguíneo
cerebral, 12-14, lo cual , si
está presente en recién nacidos extremadamente prematuros, podría causar isquemia cerebral
ó hemorragia. Debe destacarse que los estudios en los
corderos aunque son muy fisiológicos no imitan la práctica clínica. Los
corderos fueron anestesiados para permitir a los investigadores un control
completo sobre el momento de inicio de las respiraciones.
Viabilidad y seguridad de ventilar recién nacidos
prematuros previo a clampeo de cordón umbilical.
No se identificaron problemas
significativos con la viabilidad ó seguridad en este pequeño estudio piloto
de proporcionar CPAP ó VPP para neonatos < 24 a 32 semanas de gestación mientras que
estban unidos a la placenta durante 90 segundos después del nacimiento. Otros
estudios también han demostrado la viabilidad y la seguridad utilizando
protocolos algo diferentes. En el estudio Cord Pilot Trial, centros en el Reino Unido
randomizaron neonatos < 32 semanas de gestación a clampeo inmediato de cordón versus
clampeo de cordón retrasado al
menos a los 2 minutos, con asistencia ventilatoria realizada según
necesidad en el grupo randomozado a clampeo retrasado.23 En un estudio de un solo centro
en Estados Unidos (Neonatal Resuscitation with Intact Cord,
NCT02231411), 24
niños nacidos entre 23 y 31 semanas de gestación se sometieron a 60
segundos de clampeo de cordón retrasado, con neonatos randomizados a atención de rutina
(incluyendo estimulación) ó asistencia ventilatoria (CPAP ó VPP) durante
clampeo retrasado de cordón. No
se han reportado hasta la fecha preocupaciones significativas sobre viabilidad ó seguridad en
estos estudios piloto.
Desafíos en este Protocolo y posibles
soluciones, son los siguientes :
-
Consentimiento y preparación:
los autores no pudieron
llevar a cabo el protocolo en la mayoría de los partos elegibles debido ya sea a
la imposibilidad de acercarse a las madres para consentimiento,
consentimiento bajo (31% de las madres a las que se solicitó) ó tiempo insuficiente para
preparar el equipo VentFirst y equipo humano (13% de los que consintieron). Con
el
protocolo actual, los autores estiman que se requiere un extra de 15 minutos para
que los neonatólogos preparen la intervención. Con el aumento de los
esfuerzos y de la educación del equipo neonatal sobre consentimiento y
configuración del equipo, los autores anticipan que serán capaces de mejorar la fracción de
partos
elegibles que se puedan incluir en futuros estudios, tanto a través de la
familiaridad con el setup del Protocolo y a través de modificaciones adicionales de
las estrategias de configuración del equipamiento. Para mejorar y simplificar el
proceso de consentimiento, como complemento al consentimiento por
escrito, los autores planean añadir un video de instrucción para ayudar a
los padres a entender el estudio.
-
Hacinamiento: los autores han sido capaces de
conseguir suficiente acercamiento al neonato para proporcionar adecuadamente CPAP
ó VPP (ventiación a presión positiva) pero los clínicos de
obstetricia y neonatología comentan que el
hacinamiento en la mesa de partos era un problema con el enfoque actual de
atención con 2 neonatólogos. Otros grupos han informado de
que un único neonatólogo es suficiente para proporcionar asistencia ventilatoria durante
el clampeo retrado de cordón umbilical.
-
Detección de Frecuencia cardíaca :
se
utilizó un enfoque estándar de palpación gentil del cordón a los 60 segundos para
evaluar la frecuencia cardíaca del neonato que fue en todos los 29 recién nacidos
estimada en más de 100 latidos por minuto. Existe la preocupación de que la
palpación del cordónn constriñe el flujo sanguíneo hacia el neonato y es inexacta para
la estimación de frecuencia cardíaca. Los autores colocaron censores de oximetría de pulso en varios
neonatos VentFirst inmediatamente después del parto vaginal, pero
ellos mostraron lecturas de
frecuencia cardíaca y de saturación de oxígeno que se sentían alsamente bajas durante varios minutos.
Se ha demostrado que el electrocardiograma (ECG) es un método rápido y
seguro de medición de frecuencia cardíaca en sala de partos. Una señal
ECG obtenida continuamente comenzando poco después del nacimiento sería
ventajosa, permitiendo la evaluación del bienestar y adecuación de la ventilación.25,26 Sin embargo, en este momento, no hay derivaciones de ECG
disponibles en el mercado que sean empaquetadas de forma estéril, lo que impide
su colocación durante parto por cesárea por las preocupaciones que puedan
contaminar el campo estéril.
-
Superficie para reanimación, equipo
y termorregulación: los autores encontraron que colocar al RN en un colchón de
calentamiento químico sobre la pelvis de la madre para partos por cesárea ó en
un pequeño soporte sobre ruedas para los partos vaginales permitió una
estabilidad adecuada para la administración de CPAP ó VPP. Una envoltura de
polietileno estéril también se usa para evitar la hipotermia. Los autores
montaron un equipo
de reanimación que incluye un resucitador con pieza en T (Neopuff) y
cilindros de oxígeno y
aire en un poste ó columna por separado, lo que permitió a los neonatólogos
maniobrar cerca del RN. Algunos otros centros que realizan estudios
pilotos de
ventilación de recién nacidos prematuros durante Clampeo retrasado de cordón han
utilizado un carro disponible en el mercado (LifeStart Trolley, Inditherm) ,
el cual tiene un sistema incorporado en la plataforma de calentamiento para
estabilización del recién nacido y fue diseñado con tamaño reducido para
poder acercarse al área de parto. Material de reanimación se puede montar en
este carro.27
-
Esterilidad: El equipo de obstetricia
no sintió que el campo estéril fuese afectado en 21 partos por cesárea VentFirst. El
único equipo de reanimación no estéril ó encerrado en una cubierta estéril fueron
la máscara facial para CPAP y VPP, un pequeño detector de CO2 y el aparato de pieza en T en el extremo
de la máscara del
dispositivo de reanimación. Estos fueron retirados de envases de equipo médico
limpio inmediatamente antes del parto y fueron manejadas por un solo
neonatólogo que fue instruído de no tocar el campo quirúrgico estéril ni a
los obstetras. Los autores no encontraron ningún informe de infecciones post cesárea en
estos 21 partos.
Conclusiones y Direcciones
futuras
Para neonatos prematuros extremos, muchos
de los cuales no respiran bien por su cuenta inmediatamente después del parto, proporcionar asistencia ventilatoria mientras están unidos a la placenta
puede tener un doble beneficio : permitir al recién nacido recibir células
sanguíneas y volumen adicionales y asegurar la inflación pulmonar antes de
la separación de la placenta de baja resistencia que suministra oxígeno. 10,28,29
Los autores del presente estudio y otros autores, hemos demostrado ahora que es factible y seguro
para cumplir
con las guías del PRN (protocolo de reanimación neonatal) proporcionar soporte ventilatorio a los
prematuros durante un período prolongado de desprendimiento de placenta
después del nacimiento.
La experiencia de los autores en la realización de
este estudio piloto les ha permitido afinar su protocolo
experimental hasta el punto de sentir que podría llevarse a cabo en varios
centros. Cabe señalar, sin embargo, que este fue un pequeño estudio piloto.
Hasta que el beneficio clínico haya sido demostrado, esta técnica debe considerarse
experimental y no recomendada para su aplicación en la práctica de rutina.
Los autores
ahora intentan realizar un gran estudio multicéntrico randomizado de neonatos < 29 semanas de gestación.
El grupo con intervención
recibirá ventilación asistida, según sea necesario, durante 120 segundos de
clampeo retrasado de cordón,
en comparación con la atención estándar, que se define como un máximo de 60
segundos de Clampeo retrasado de cordón sin ventilación asistida, siempre y cuando el
RN esté
respirando espontáneamente. El outcome primario será la incidencia
de HIV (hemorragia intraventricular) evaluada con Ecografía cerebral
a los 7 a 10 días vida.
Agradecimientos
Los autores agradecen a los padres
que dieron su consentimiento para participar en este estudio, a los miembros del
equipo neonatal y obstétrico por sus esfuerzos para optimizar los protocolos,
a Laerdal
Medical por proporcionar un maniquí de reanimación para su uso en el
entrenamiento con simulación y a la Escuela de Medicina de la Universidad de Virginia y Departamento de
Pediatría por proporcionar fondos para este estudio.
Referencias
-
Behrman RE, Butler AS. Preterm Birth:
Causes, Consequences and Prevention.Washington, DC: Institute of Medicine of
the National Academies; 2007
-
Whitelaw A. Core concepts:
Intraventricular hemorrhage. NeoReviews 2011;12(2):e94–e101
-
Sharp J. The Midwives Book: Or the
Whole Art of Midwifry Discovered (Women Writers in English 1350–1850). Hobby
E, ed. 1st ed. New York, NY: Oxford University Press; 1999
-
Budin P. A quel moment doit-on
pratiquer la ligature du cordon ombilical? Prog Med (Paris)
1875;3(51):765–767
-
Yao AC, Moinian M, Lind J.
Distribution of blood between infant and placenta after birth. Lancet
1969;2(7626):871–873
-
Aflaifel N, Weeks A. Push, pull,
squeeze, clamp: 100 years of changes in the management of the third stage of
labour as described by Ten Teachers. BMJ 2012;345:e8270
-
Kattwinkel J, Ed. Textbook of Neonatal
Resuscitation. 6th ed. Elk Grove Village, IL: American Academy of Pediatrics/American
Heart Association; 2011
-
McDonald SJ, Middleton P, Dowswell T,
Morris PS. Effect of timing of umbilical cord clamping of term infants on
maternal and neonatal outcomes. Cochrane Database Syst Rev 2013;7:CD004074
-
Rabe H, Diaz-Rossello JL, Duley L,
Dowswell T. Effect of timing of umbilical cord clamping and other strategies
to influence placental transfusion at preterm birth on maternal and infant
outcomes. (Review) Cochrane Database Syst Rev 2012;8:CD003248
-
Committee on Obstetric Practice,
American College of Obstetricians and Gynecologists. Timing of umbilical
cord clamping after birth. Committee Opinion No. 543. American College of
Obstetricians and Gynecologists. Obstet Gynecol 2012;120:1522–1526
-
KimAJH,Warren JB. Optimal timing of
umbilical cord clamping: Is the debate settled? Part 2 of 2: Evidence in
preterm and term infants, alternatives, and unanswered questions. NeoReviews
2015;16(5):e270–e277
-
Hooper SB, Te Pas AB, Lang J, et al.
Cardiovascular transition at birth: a physiological sequence. Pediatr Res
2015;77(5):608–614
-
Polglase GR, Dawson JA, Kluckow M, et
al. Ventilation onset prior to umbilical cord clamping (physiological-based
cord clamping) improves systemic and cerebral oxygenation in preterm lambs.
PLoS ONE 2015;10(2):e0117504
-
Bhatt S, Alison BJ, Wallace EM, et al.
Delaying cord clamping until ventilation onset improves cardiovascular
function at birth in preterm lambs. J Physiol 2013;591 (8):2113–2126
-
Volpe JJ. Intraventricular hemorrhage
in the premature infant— current concepts. Part II. Ann Neurol
1989;25(2):109–116
-
Georgiadis L, Keski-Nisula L, HarjuM,
et al. Umbilical cord length in singleton gestations: a Finnish population-based
retrospective register study. Placenta 2014;35(4):275–280
-
Naeye RL. Umbilical cord length:
clinical significance. J Pediatr 1985;107(2):278–281
-
Andersson O, Lindquist B, Lindgren M,
Stjernqvist K, Domellöf M, Hellström-Westas L. Effect of delayed cord
clamping on neurodevelopment at 4 years of age: a randomized clinical trial.
JAMA Pediatr 2015;169(7):631–638
-
Hill AL, Fontenot HB. Beliefs and
practices of obstetric care providers regarding umbilical cord clamping.
Nurs Womens Health 2014;18(5):413–419
-
Oddie S, Rhodes P; Very Preterm Birth
Qualitative Collaborative Group. Barriers to deferred cord clamping in
preterminfants. Arch Dis Child Fetal Neonatal Ed 2014;99(5):F391–F394
-
Ersdal HL, Linde J, Mduma E, Auestad
B, Perlman J. Neonatal outcome following cord clamping after onset of
spontaneous respiration. Pediatrics 2014;134(2):265–272
-
Nevill E, Meyer MP. Effect of delayed
cord clamping (DCC) on breathing and transition at birth in very preterm
infants. Early Hum Dev 2015;91(7):407–411
-
Bradshaw LE, Pushpa-Rajah A, Dorling
J, Mitchell EJ, Duley L; Cord Pilot Trial Collaborative Group. Cord pilot
trial: update to randomised trial protocol. Trials 2015;16(1):407. Available
at http://www.trialsjournal.com/content/16/1/407
-
Katheria A, Rich W, Finer N.
Optimizing care of the preterm infant starting in the delivery room. Am J
Perinatol 2016;33(3): 297–304
-
Katheria A, RichW, Finer N.
Electrocardiogram provides a continuous heart rate faster than oximetry
during neonatal resuscitation. Pediatrics 2012;130(5):e1177–e1181
-
van Vonderen JJ, Hooper SB, Kroese JK,
et al. Pulse oximetry measures a lower heart rate at birth compared with
electrocardiography. J Pediatr 2015;166(1):49–53
-
Weeks AD, Watt P, Yoxall CW, et al.
Innovation in immediate neonatal care: development of the Bedside Assessment,
Stabilisation and Initial Cardiorespiratory Support (BASICS) trolley. BMJ
Innov 2015;1(2):53–58
-
Perlman JM, Wyllie J, Kattwinkel J, et
al; Neonatal Resuscitation Chapter Collaborators. Part 11: neonatal
resuscitation: 2010 International Consensus on Cardiopulmonary Resuscitation
and Emergency Cardiovascular Care Science with Treatment Recommendations.
Circulation 2010;122(16, Suppl 2):S516–S538
-
World Health Organization. Optimal
timing of cord clamping for the prevention of iron deficiency anaemia in
infants. Available at http:// www.who.int/elena/titles/cord_clamping/en/.
Accessed September 23, 2015




