Ventilación No Invasiva
Enero 2016
Soporte respiratorio no invasivo
James J. Cummings, Richard A. Polin, MD, Comité on Fetus and Newborn
Pediatrics Volume 1 37, number 1 , January 2016: e2 0153758
Traducción libre Dr Gerardo Flores H Pediatra Neonatólogo Puerto Montt Chile
Introducción
La ventilación mecánica
aumenta la sobrevida
en recién nacidos prematuros con insuficiencia
respiratoria; sin embargo, se asocia con mayor riesgo de displasia
broncopulmonar (DBP) y outcomes
adversos del neurodesarrollo.1
Los intentos
para
disminuir el daño pulmonar
usando estrategias de ventilación
gentil y restringiendo
el uso de oxígeno han dado como resultado sólo modestas
mejoras en la incidencia de DBP.2
En 1987 , Avery
y cols 3 publicaron
un pequeño
estudio observacional sugiriendo
que el uso de presión positiva continua en vía
aérea (CPAP) como modo primario
de soporte respiratorio redujo la necesidad
de oxígeno suplementario a los 28 días de vida.
Estudios clínicos randomizados más recientes han demostrado que, en comparación con el uso profiláctico
ó precoz de
surfactante , el uso de CPAP disminuye la necesidad de ventilación
mecánica invasiva y el outcome combinado de muerte
ó DBP.4,5
Los
neonatos más inmaduros (24-25 semanas
de edad gestacional) pueden beneficiarse
más de esta estrategia, 6 incluso aunque
todos los estudios randomizados
hasta
la fecha han demostrado una alta tasa de fracaso de
CPAP en estos niños. CPAP
también se ha utilizado para tratar la apnea del prematuro y se considera una
estrategia basada en la evidencia para disminuir
fracaso postextubación.7-10 La búsqueda de
como mejorar el CPAP en
el manejo de
prematuros con insuficiencia respiratoria ha identificado
2 estrategias
adicionales de ventilación no invasiva
:
Alternando presiones positivas nasales, ya sea con ventilación nasal a presión positiva intermitente (VNPPI) ó CPAP nasal con dos niveles (BiPAP) y
Cánula nasal de alto flujo (CNAF).
Numerosos estudios observacionales han investigado la utilidad de VNPPI ó CNAF para una variedad de trastornos neonatales, 11-24, pero sólo los estudios clínicos randomizados con comparaciones directas a CPAP nasal (nCPAP) son utilizados como información para esta Declaración del Comité Feto y Recién nacido de la AAP. Es importante tener en cuenta que cuando se utiliza la CPAP para la comparación, las tecnologías utilizadas para proporcionar presión positiva (ventilador ó CPAP de burbuja) y las estrategias utilizadas para disminuir la fuga de aire a través de la boca (inmovilización del mentón ó chupete) difieren entre los estudios.
1.- VNPPI
y BIPAP
Consideraciones técnicas
VNPPI utiliza más comúnmente un ventilador para proporcionar respiraciones intermitentes con presiones inspiratoria máxima y frecuencias respiratorias similares a las utilizadas para la ventilación mecánica. VNPPI también se ha utilizado en combinación con ventilación de alta frecuencia.25
Los sistemas de BiPAP proporcionan respiraciones suspiro con presiones mucho más bajas, tiempos de inflación más largos (0,5 a 1,0 segundos para presió NCPAP más alta), ciclos de frecuencia respiratoria más bajos (10-30 por minuto) y diferencias pequeñas (< 4 cm de H2O) entre las presiones NCAP alta y baja.
Estudios clínicos randomizados de VNPPI en recién nacidos humanos han utilizado un amplio rango de presiones peak ó máximas ó PIP (presión H2O 10-25 cm) y frecuencias de ventilador (10-60 por minuto), tiempos de inflación variable (0,3-0,5 segundos) y respiraciones sincronizadas ó no sincronizadas. Tanto VNPPI como BiPAP se utilizan generalmente en un modo no sincronizado. Las respiraciones intermitentes generalmente se entregan a través de cánulas nasales dobles cortas, aunque se han utilizado máscaras 26 y tubos nasofaríngeos largos. 27
La sincronización de las respiraciones es difícil con VNPPI ó BiPAP. Una cápsula neumática colocado en el abdomen se utilizó en el ventilador Infant Star para permitir gatillado del paciente , pero este ventilador ya no está disponible. El dispositivo Infant Flow Advance BiPAP, que utiliza un gatillador abdominal, no está aprobado para su uso en Estados Unidos. Otras formas de sincronización utilizando asistencia ventilatoria ajustada neuralmente, 28,29 gatillado por flujo, 30 gatillado por presión, 31 ó pletismografía de inductancia respiratoria 32,33 no han sido investigadas en grandes estudios randomizados.
P
rincipios fisiológicos
VNPPI ofrece la principal ventaja fisiológica de CPAP (es decir, estabilización de alvéolos por presión positiva de vía aérea) y teóricamente promueve una mejor ventilación mediante la entrega de respiraciones a presión positiva a las vías respiratorias inferiores. Además, la VNPPI puede gatillar un reflejo inspiratorio aumentado (reflejo paradójico de Head) en recién nacidos prematuros.
Datos de lechones deficientes en surfactante indican que la VNPPI causa menos inflamación pulmonar que la ventilación mandatoria intermitente sincronizada.34 Los beneficios fisiológicos de la VNPPI pueden depender de si las respiraciones son sincronizadas ó no sincronizadas. Estudios realizados en prematuros 30,32,35,36 indican que, en comparación con CPAP, la VPPIN sincronizada disminuyó el trabajo respiratorio, mejoró la asincronía toracoabdominal, aumentó el volumen Tidal y la ventilación minuto y disminuyó las concentraciones de dióxido de carbono.
Simiarmente, Ali y cols 33 y Chang y cols 37 encontraron que la VNPPI sincronizada mejoró la sincronía toracoabdominal 33 y disminuyó el esfuerzo inspiratorio 33,37 pero no mostró ningún beneficio sobre el volumen tidal, ventilación minuto ó PCO2. En contraste, Owen y cols 38 encontraron que VNPPI no sincronizada aumentó el volumen tidal en un modesto 15% durante la inspiración, sin efecto consistente durante la espiración. La presión entregad durante la espiración enlenteció la frecuencia respiratoria (por la prolongación de espiración).
La VNPPI aplicada durante episodios de apnea aumentó volúmenes tidal sólo el 5% de las veces, lo que sugiere la importancia de la sincronización de la VNPPI con una glotis abierta .38 Presiones peak (PIP) más altas no aumentaron consistentemente la probabilidad de inflación del tórax. Además, Owen y cols 39 demostraron que la presión suministrada a la rama inspiratoria de las cánulas nasales fue altamente variable y era más alta y más variable cuando el neonato se movía.39
Las variaciones en la presión suministrada pueden reflejar diferentes niveles de resistencia a nivel de la glotis. Aumentar la presión inspiratoria máxima (PIP ó PIM)no entrega consistentemente una presión más alta para el neonato, lo que sugiere que programar una presión inspiratoria máxima más alta puede no proporcionar asistencia respiratoria adicional.
Al igual que en los estudios descritos anteriormente, Miedema y cols observaron que BiPAP no sincronizada (utilizando el sistema Infant Flow SiPAP) no aumentó los volúmenes tidales (corrientes) ó disminuyó la PaCO2 transcutánea en prematuros estables. 40 Sin embargo, Migliori y cols 40 (usando un diseño cruzado) demostraron que BiPAP no sincronizado en comparación con nCPAP en prematuros de 24 a 31 semanas de edad gestacional mejoró significativamente la ventilación y oxigenación en un estudio de 4 horas.41
VNPPI para Apnea de la Prematuridad
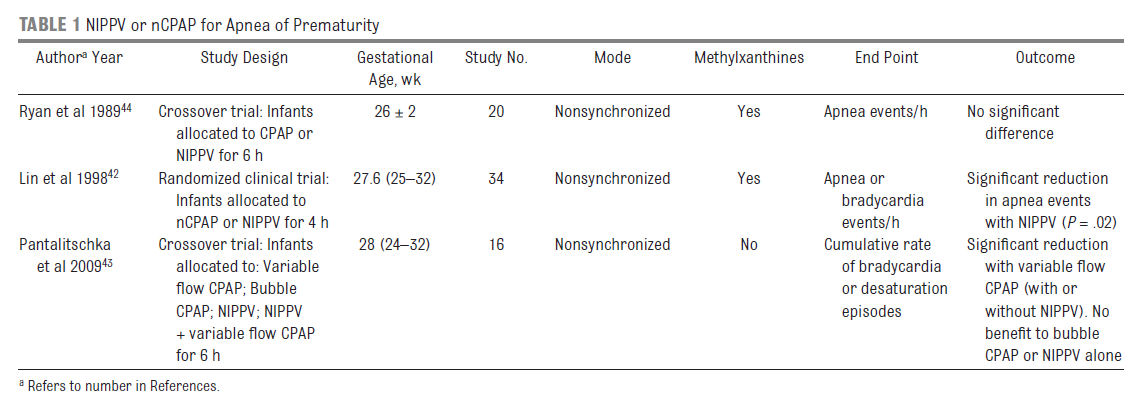
Los estudios randomizados de VNPPI no sincronizada para la apnea del prematuro incluyeron pequeño número de niños, eran en su mayoría de corta duración (
Tabla 1) y no han revelado beneficio consistente.42-44 En el estudio de Ryan y cols 44, no se transmitieron las presiones peak (PIM) a la pared torácica, lo cual es consistente con obstrucción de la vía aérea superior.

Hay muy poca evidencia para apoyar la eficacia de la VNPPI para la apnea; Sin embargo, una reciente revisión Cochrane concluyó, "VNPPI puede ser un método útil de aumentar los efectos beneficiosos de nCPAP en recién nacidos prematuros con apnea frecuente o grave. Datos adicionales de seguridad y eficacia se requieren antes de recomendar la VNPPI como tratamiento estándar para la apnea."9 Ningún estudio usando VNPPI sincronizada en neonatos con apnea ha sido realizado.
VNPPI ó nCPAP para prevención de fracaso postextubación
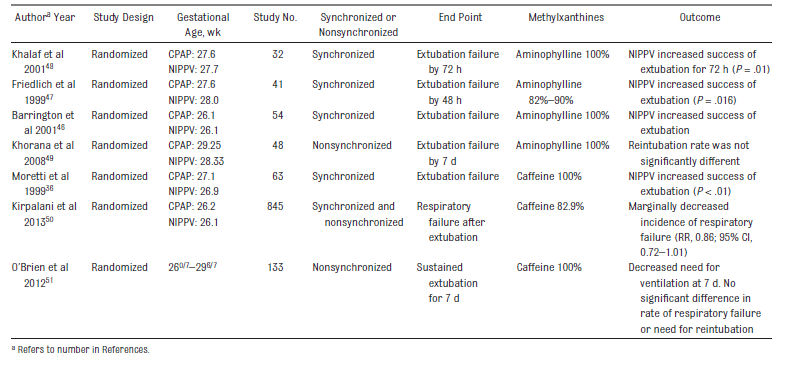
VNPPI se ha comparado con nCPAP para la prevención del fracaso posterior a extubación en prematuros 36,45-52 (
Tabla 2)* El estudio de Kirpalani incluyó recién nacidos con síndrome de distress respiratorio (SDR; preintubación) y recién nacidos con SDR después de extubación y permitió el uso de VNPPI con ventilador sincronizado ó no sincronizado) y el uso de dispositivos con dos niveles.
El estudio de O'Brien y cols 51 usó dispositivos binivel. El más reciente meta-análisis de Cochrane concluyó que la VNPPI disminuye el riesgo de reunir criterios de insuficiencia respiratoria post extubación (riesgo relativo [RR], 0,71; 95% intervalo de confianza [IC], 0,61-0,82) y la necesidad de reintubación (RR, 0,76; IC del 95%, 0.65- 0.88) .7 Esos beneficios se observaron más consistentemente en estudios que usaron VNPPI sincronizada.
*
Un estudio de Gao y cols 47 no se incluyó en Tabla 2, debido a que enroló neonatos más maduros. Similarmente, el estudio Ramanathan y cols 54 no se incluyó debido a que los RN asignados randomizadamente a VNPPI fueron extubados más pronto que aquellos asignados randomizadamente a nCPAP, los que permanecieron ventilados por un período más largo de tiempo.
Tabla 2.- VNPPI ó nCPAP para prevención de fracaso postextubación
VNPPI ó nCPAP para manejo de prematuros con SDR
El uso precoz de CPAP con administración posterior selectiva de surfactante en recién nacidos extremadamente prematuros causa menores tasas de DBP / muerte en comparación con la administración profiláctica ó más precoz de surfactante.56 Por otra parte, el inicio precoz de CPAP puede causar disminución de la duración de ventilación mecánica y disminución de la necesidad de tratamiento con corticosteroides postnatales. La VNPPI ha sido investigada como una alternativa a la CPAP para el manejo agudo de recién nacidos con SDR (Tabla 3) .7,57-63 Siete estudios randomizados han comparado nCPAP con VNPPI para el manejo inicial de recién nacidos con SDR (Tabla 3). Todos menos 2 estudios 50,64 neonatos incluyeron neonatos > 30 semanas de gestación, la cual es una población con menos probabilidades de fracasar en CPAP ó desarrollar DBP.
Tabla 3.- VNPPI ó nCPAP para prematuros con SDR
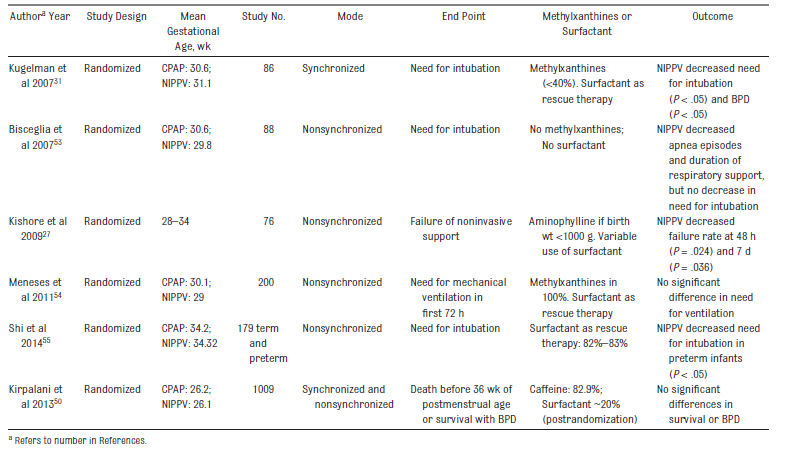
Sólo un estudio fue empoderado para detectar una diferencia en la incidencia de DBP y ninguno de los estudios fué ciego.27,31,50,53-55,63,64 Sólo un estudio randomizado ha sido publicado que limitó el enrolamiento a neonatos < 30 semanas de gestación .50 En este estudio, 1.099 recién nacidos con SDR fueron asignados randomizadamente a recibir VNPPI (por ventilador, sincronizado o no sincronizado ó usando dispositivo binivel) ó nCPAP. 51 % de los recién nacidos del estudio se enrolaron después de la extubación. El outcome primario fue muerte antes de las 36 semanas de edad postmenstrual ó sobrevida con DBP (criterio del National Institute of Child Health and Human Development criteria ó test de reducción de oxígeno).
La edad gestacional media fue de 26 semanas; 38,4% del grupo VNPPI murieron ó sobrevivieron con DBP (versus 36,7% del grupo de nCPAP [ p = 0,56]). No hubo diferencias en la duración de la asistencia respiratoria ó sobrevida sin DBP en los neonatos asignados randomizadamente a los grupos VNPPI ó nCPAP.
Seguridad de VNPPI
La mayoría de los estudios randomizados resumidos anteriormente eran pequeñs y sin el suficiente poder para detectar complicaciones graves tales como perforación del tracto gastrointestinal. Aunque se ha observado distensión abdominal, no ha sido clínicamente significativa. La tasa de enterocolitis necrotizante no se ve afectada por el uso de VNPPI .7 La capacidad de VNPPI para causar erosión/trauma del tabique nasal / trauma no se ha estudiado adecuadamente, pero es probable que sea similar a la observada con nCPAP.50
nCPAP bifásico (BiPAP) Versus nCPAP
BiPAP es una forma de ventilación no invasiva que proporciona 2 niveles alternantes de presión positiva continua de vía aérea a intervalos establecidos mediante cánulas nasales ó mascarilla. Dos estudios clínicos prospectivos randomizados han evaluado nCPAP versus BiPAP. Lista y colaboradores 65 asignaron al azar a 40 recién nacidos prematuros con SDR y una edad gestacional media de 30 semanas a recibir BiPAP sincronizado (Infant Flow) ó nCPAP (Infant Flow) después de la administración de surfactante y extubación.
Los RN asignados al azar a recibir nCPAP tuvieron una duración significativamente más prolongada de la asistencia respiratoria (media ± SD : CPAP, 13.8 ± 8 días, versus BiPAP, 6.5 ± 4 días; p = 0,027). O'Brien y cols 51 asignaron randomizadamente 128 recién nacidos (edad gestacional media, 27 semanas) a recibir BiPAP no sincronizado (Infant flow) ó nCPAP (Infant Flow) después de extubación. El criterio principal de valoración en este estudio, extubación mantenida (≥ 7 días), no fue diferente entre los grupos. La retinopatía del prematuro (etapa 2 ó superior) fue significativamente más frecuente en el grupo BiPAP, una observación que los autores no pudieron explicar .51
Conclusiones
En comparación con nCPAP, VNPPI sincronizada disminuye la frecuencia de fracaso posterior a extubación.
Los estudios que utilizan VNPPI no sincronizada ó BiPAP para fracaso post - extubación no son concluyentes.
Los datos no apoyan la superioridad de VNPPI / BiPAP (sincronizado ó no sincronizado) sobre la nCPAP para el manejo de recién nacidos con SDR.
No hay evidencia publicada de beneficio de la VNPPI ó BiPAP para apnea del prematuro; sin embargo, no han sido publicados estudios randomizados utilizando VNPPI sincronizada ó BiPAP.
Se necesita más investigación antes de recomendar VNPPI ó BiPAP sobre nCPAP para el manejo de recién nacidos con SDR ó apnea.
2.- Cánula nasal de alto flujo
Consideraciones técnicas
El término comúnmente usado "cánula nasal de alto flujo" (CNAF) es algo demasiado simplista, porque en la práctica clínica, mucho más que el flujo distingue el dispositivo CNAF de la así llamada cánula nasal bajo flujo (CNBF). La CNBajoF se utiliza principalmente para suministrar oxígeno a neonatos con enfermedad pulmonar crónica (BPD) a flujos < 1 L / minuto. Flujos más altos están reservados para lactantes y niños debido a preocupaciones sobre desecación de las vías respiratorias, lesiones de la mucosa y obstrucción de las vías respiratorias.66-68
Para el propósito de este informe, cualquier cánula que entregue gas a un flujo > 1 L / minuto será considerada de alta flujo. Sin embargo, el término CNAF se referirá específicamente a la entrega de oxígeno mezclado (blender) , calentado y humidificado. Esto se aproxima al acondicionamiento fisiológica que normalmente se realiza por la vía aérea superior durante la respiración espontánea en aire ambiente y mantiene un ambiente saludable para la mucosa nasal.
Principios fisiológicos
Una característica clave de CNAF es el preacondicionamiento del gas inspirado. Debido a que normalmente el cuerpo requiere energía metabólica para calentar y humidificar el aire que respiramos, la CNAF tiene la ventaja de reducir el gasto energético en reposo.69 Aunque CPAP también utiliza gas humidificado, calentado, un estudio in vivo reveló que la humedad del gas entregado por CNAF era significativamente mayor.37 No está claro si el aumento de la humedad entregada por CNAF es clínicamente importante. Los beneficios respiratorios clínicamente reportados de CNAF principalmente han sido menor trabajo respiratorio y disminución de necesidad de oxígeno suplementario. Existen varios mecanismos de acción propuestos para explicar estos hallazgos, aunque ninguno ha sido demostrado de manera concluyente en vivo.69
Estos incluyen los siguientes :
Disminución de la resistencia inspiratoria 23
Lavado de espacio muerto nasofaríngeo 70 y
Suministro de presión positiva de distensión de vías respiratorias.71,72
La medición de niveles de presión de distensión continua durante el uso de CNAF , tanto in vitro como in vivo, ha producido resultados variables .19,23,71-87
Sin embargo, es claro que bajo determinadas circunstancias (cánulas nasales herméticamente instaladas, altas tasas de flujo y boca cerrada) la CNAF puede generar altas presiones nasofaríngeas .71,83 Sin embargo, es poco probable que ocurran presiones excesivas con CNAF si se sigue la recomendación de los fabricantes de utilizar vástagos (prongs) de la CNAF de menos de la mitad del tamaño de las fosas nasales.
CNAF para weaning de nCPAP
No existen estudios prospectivos, randomizados de nCNAF en prematuros para facilitar weaning desde CPAP. Un estudio reciente de cohorte , pareado, en 79 prematuros ≤ 28 semanas comparando weaning de nCPAP a CNBF (bajo flujo) versus CNAF reveló que el weaning en grupo CNAF destetados desde nCPAP era significativamente más rápido, pero no hubo diferencia en la duración total del soporte respiratorio.15
CNAF despues de esquema INSURE
Se realizó un estudio
prospectivo para determinar si CNAF
puede disminuir reintubación después
de procedimiento Insure (intubación-surfactant-extubación)
en prematuros con
SDR.88 En este estudio, 45
neonatos (media de edad gestacional,
27,7 semanas) fueron asignados randomizadamente a inmediata extubación y colocación en
CNAF ó a ser mantenidos en ventilación mecánica
con weaning gradual
a extubación.
70 % (16 de 23) de los niños en el grupo
CNAF no requirió intubación, lo que sugiere que
CNAF podría ser una alternativa a la nCPAP en la prevención de reintubación después de
INSURE.
CNAF versus nCPAP para soporte respiratorio no invasivo de Prematuros
Varios estudios prospectivos randomizados han comparado CNAF versus nCPAP para manejo respiratorio de recién nacidos prematuros 89-96 (Tabla 4) †; 3 de estos estudios se han publicado sólo en forma de abstract .91,93,95
† Un estudio realizado por Campbell y cols , 91 aunque incluído en un reciente meta-análisis de uso CNAF , 99 no se incluye aquí, ya que el dispositivo utilizado en ese estudio no entrega gas totalmente calentado y humidificado.
Tabla 4.- Estudios prospectivos, randomizados de CNAF versus nCPAP para soporte respiratorio de Prematuros
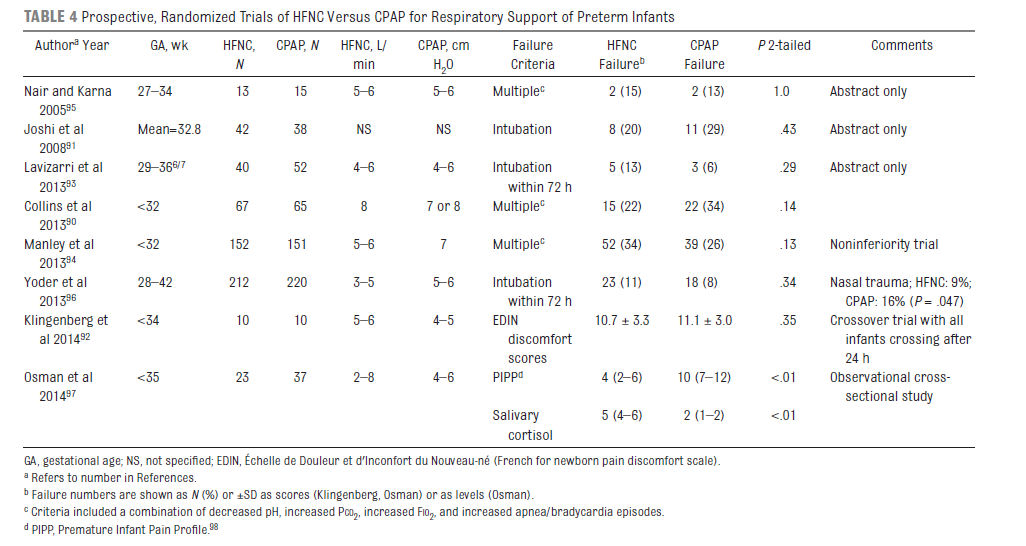
Cuatro estudios compararon CNAF versus nCPAP como soporte primario solamente, 91-93,95 ; 2 de ellos compararon CNAF versus nCPAP para apoyo post extubación, 90,94 y 1 estudio comparó CNAF versus nCPAP sea como soporte primario ó para reducir falla postextubación. 96
En los 5 estudios de soporte primario solamente 3 compararon la tasa de insuficiencia respiratoria, definida sea por empeoramiento clínico ó necesidad de intubación y no reveló differences.91, 93,95
Dos estudios adicionales no evaluaron la insuficiencia respiratoria, pero compararon los scores de dolor y / o discomfort ; un estudio transversal observacional en 60 recién nacidos prematuros reveló que la aplicación de CNAF se asoció con menos dolor en comparación con nCPAP, 97 mientras que un estudio cruzado randomizado en 20 prematuros no reveló diferencias durante el tratamiento.92
Collins y cols 90 asignaron randomizadamente 132 prematuros < 32 semanas ventilados mecánicamente a CNAF a 8 L / minuto ó nCPAP con 7 ó 8 cm H2O, dependiendo del requerimiento de oxígeno suplementario.90
El fracaso del tratamiento (definido previamente como una combinación de acidosis, hipercapnia, necesidad de oxígeno y episodios de apnea frecuentes) durante los primeros 7 días post extubación fue 22% (15 de 67) en grupo CNAf y 34% (22 de 65) en grupo de nCPAP (P = 0,14). La tasa de reintubación dentro de la primera semana fué 10% (7 de 67) en grupo CNAF y 12% (8 de 65) en grupo nCPAP (P = 0,79). Los scores de trauma nasal predefinidos (más bajos indican menor trauma) promediaron 3.1 ± 7,2 en grupo CNAF y 11.8 ± 10,7 en grupo nCPAP (P < 0,001).
Manley et al94 asignaron randomizadamente 303 prematuros (< 32 semanas edad gestacional ) ventilados a CNAF con 5 a 6 L / minuto (dependiendo del tamaño de punta ó vástago nasal) ó a nCPAP a 7 cm H2O después extubation.94 Se permitió la terapia de rescate con CPAP para los niños que fallaron en CNAF , pero lo contrario no fué permitido. Además, VNPPI no sincronizada se podía utilizar en cualquier momento en el grupo CPAP ó en cualquier recién nacido del grupo CNAF que posteriormente recibió nCPAP. La incidencia de fracaso del tratamiento por criterios predefinidos fué 34% en grupo CNAF y 26% en grupo nCPAP (P = 0,13). ‡ La tasa de reintubación fue 18% (27 de 152) en el grupo CNAF y 25% (38 de 151) en grupo de nCPAP (P = 0,12). Traumatismo nasal fue más frecuente en el grupo de CPAP (P = 0,01). La incidencia de otros eventos adversos graves no fue diferente entre grupos.99
‡ La randomización se estratificó por edad gestacional (< 26 versus ≥ 26 semanas). Aunque no alcanzó significación estadística, hubo una mayor diferencia en la tasa de fracaso entre los grupos de tratamiento en el estrato más inmaduro (81,3% en grupo CNAF versus 61,3% en grupo nCPAP). Esto es consistente con una encuesta reciente de matronas de UCIN , la mayoría de las cuales cree que CNAF era menos probable que nCPAP para prevenir la reintubación de neonatos de 24 a 26 semanas de edad gestacional.98
Yoder y cols 96 asignaron randomizadamente 432 neonatos (rango de edad gestacional, 28-42 semanas) dentro de las 24 horas del nacimiento, a evitar intubación (n = 141) ó después de la ventilación mecánica (n = 291) 96 a recibir ya sea CNAF (3- 5 L / minuto de flujo, dependiendo del peso) ó nCPAP (5-6 cm H2O), utilizando varios dispositivos. Las cánulas nasales utilizadas en este estudio permitieron un espacio de aproximadamente 50% entre cada diámetro exterior de los vástagos (prongs) y el diámetro interno de la respectiva fosa nasal y el flujo libre alrededor de los vástagos era determindo por auscultación periódica. Fracaso de extubación, definido como reintubación dentro de 72 horas, fue 10,8% en grupo CNAF y 8,2% en grupo nCPAP (P = 0,34). La intubación en cualquier momento se produjo en el 15,1% de los recién nacidos en grupo CNAF y 11,4% de niños en grupo nCPAP (P = 0,25). La incidencia de trauma nasal fue 9% en grupo CNAf y 16% en grupo nCPAP (P = 0,047).
Una revisión Cochrane publicada en 2011 concluyó que había evidencia insuficiente para establecer la seguridad y eficacia de CNAF en comparación con nCPAP.100 Sin embargo, en el momento de la revisión, sólo dos estudios, ambos publicados sólo como abstracts, habían sido reportados.91, 95 Los 5 estudios clínicos randomizados (con un total de 979 recién nacidos) reportados después de 2011 en conjunto sugieren que CNAF es comparable a nCPAP en el manejo del SDR ó prevención del fracaso post extubación y que CNAF causa menos trauma nasal.
Miller y cols 101 asignaron randomizadamente 40 prematuros ventilados (edad gestacional 26-29 semanas) a 1 de 2 dispositivos CNAF después de extubación inicial .101 A estos prematuros se les dió una dosis de carga de cafeína y luego se extubaron y se colocaron en el dispositivo CNAF a 6 L / minutos. La incidencia de fracaso del tratamiento, definida como la necesidad de reintubación dentro de 72 horas post extubación inicial, fue 18% (3 de 17) en un grupo y 9% (2 de 22) en el otro (P = 0,64). La necesidad de intubación dentro de 7 días de extubación inicial fue 30% (5 de 17) en un grupo y 27% (6 de 22) en el otro (p = 1,0).
Seguridad de CNAF
La CNAF crea aumento de la presión de la vía aérea proximal y, al igual que con todas las formas de presión positiva, hay un riesgo de disección traumática por aire.102,103
Las válvulas de liberación de presión incorporadas en algunos dispositivos HFNC pueden no ser suficiente para evitar presión excesiva .83Debe darse cuidadosa atención al tamaño de los vástagos (prongs ó puentes nasales) para permitir una fuga adecuada entre los vástagos y orificios nasales del prematuro, así como al uso de los flujos eficaces más bajos. Ningún estudio randomizado hasta la fecha ha sido lo suficientemente grande como para hacer frente a los problemas de seguridad; sin embargo, estudios recientes de casi 500 neonatos asignados randomizadamente a CNAF en conjunto sugieren que la tasa de pérdida de aire es comparable a la de nCPAP.
Conclusiones
Los dispositivos CNAF utilizados en prematuros deben preacondicionar los gases inspiratorios cerca de las condiciones normales de gas traqueal (37 ° C y humedad relativa del 100%).
Los dispositivos CNAF que precondicionan la mezcla de gas inspiratorio y entregan de 2 a 8 flujo L / minuto pueden ser una alternativa eficaz a la nCPAP para fracaso post extubación. Sin embargo, se necesitan más datos.
La CNAF puede estar asociada con menos trauma nasal que nCPAP, a flujos en CNAF de hasta 8 L / minuto.
CNAF puede generar altas presiones nasofaríngeas impredecibles y tiene potencial para disección de aire traumática; especial atención al tamaño de los vástagos, demostración de una fuga de aire adecuada entre los vástagos (prongs) y las fosas nasales y el uso de flujos clínicamente efectivos más bajos reducirá este riesgo.
Ninguno de los estudios publicados sobre CNAF han sido suficientemente empoderados para determinar la seguridad de CNAF.
Abreviaturas
BiPAP: bilevel nasal positive airway pressure
BPD: bronchopulmonary dysplasia (DBP)
CI: confidence interval
CPAP: continuous positive airway pressure
HFNC: high-flow nasal cannula (CNAF)
LFNC: low-flow nasal cannula (CNBA)
nCPAP: nasal continuous positive airway pressure
NIPPV: nasal intermittent positive pressure ventilation (VNPPI)
RDS: respiratory distress syndrome (SDR)
RR: relative risk
Referencias
Natarajan G, Pappas A, Shankaran S, et al. Outcomes of extremely low birth weight infants with bronchopulmonary dysplasia: impact of the physiologic defi nition. Early Hum Dev. 2012;88(7):509–515
Berger TM, Fontana M, Stocker M. The journey towards lung protective respiratory support in preterm neonates. Neonatology. 2013;104(4):265–274
Avery ME, Tooley WH, Keller JB, et al. Is chronic lung disease in low birth weight infants preventable? A survey of eight centers. Pediatrics. 1987;79(1):26–30
Fischer HS, Bührer C. Avoiding endotracheal ventilation to prevent bronchopulmonary dysplasia: a metaanalysis. Pediatrics. 2013;132(5). Available at: www. pediatrics. org/ cgi/ content/ full/ 132/ 5/ e1351
Schmölzer GM, Kumar M, Pichler G, Aziz K, O’Reilly M, Cheung PY. Non-invasive versus invasive respiratory support in preterm infants at birth: systematic review and meta-analysis. BMJ. 2013;347(347):f5980
Carlo WA, Finer NN, Walsh MC, et al; SUPPORT Study Group of the Eunice Kennedy Shriver NICHD Neonatal Research Network. Target ranges of oxygen saturation in extremely preterm infants. N Engl J Med. 2010;362(21):1959–1969
Davis PG, Lemyre B, de Paoli AG, Kirpalani H. Nasal intermittent positive pressure ventilation (NIPPV) versus nasal continuous positive airway pressure (NCPAP) for preterm neonates after extubation. Cochrane Database Syst Rev. 2001; (3):CD003212
Henderson-Smart DJ, Subramaniam P, Davis PG. Continuous positive airway pressure versus theophylline for apnea in preterm infants. Cochrane Database Syst Rev. 2001; (4):CD001072 [Review]
Lemyre B, Davis PG, de Paoli AG. Nasal intermittent positive pressure ventilation (NIPPV) versus nasal continuous positive airway pressure (NCPAP) for apnea of prematurity. Cochrane Database Syst Rev. 2002; (1) :CD002272
Miller MJ, Carlo WA, Martin RJ. Continuous positive airway pressure selectively reduces obstructive apnea in preterm infants. J Pediatr. 1985;106(1):91–94
Bhandari V, Finer NN, Ehrenkranz RA, et al; Eunice Kennedy Shriver National Institute of Child Health and Human Development Neonatal Research Network. Synchronized nasal intermittent positive-pressure ventilation and neonatal outcomes. Pediatrics. 2009;124(2):517–526
Bhandari V, Gavino RG, Nedrelow JH, et al. A randomized controlled trial of synchronized nasal intermittent positive pressure ventilation in RDS. J Perinatol. 2007;27(11):697–703
Cavari Y, Sofer S, Rozovski U, Lazar I. Non invasive positive pressure ventilation in infants with respiratory failure. Pediatr Pulmonol. 2012;47(10):1019–1025
de Jongh BE, Locke R, Mackley A, et al. Work of breathing indices in infants with respiratory insuffi ciency receiving high-fl ow nasal cannula and nasal continuous positive airway pressure. J Perinatol. 2014;34(1) 27–32
Fernandez-Alvarez JR, Gandhi RS, Amess P, Mahoney L, Watkins R, Rabe H. Heated humidifi ed high-fl ow nasal cannula versus low-fl ow nasal cannula as weaning mode from nasal CPAP in infants ≤28 weeks of gestation. Eur J Pediatr. 2014;173(1):93–98
Holleman-Duray D, Kaupie D, Weiss MG. Heated humidifi ed high-fl ow nasal cannula: use and a neonatal early extubation protocol. J Perinatol. 2007;27(12):776–781
Jackson JK, Vellucci J, Johnson P, Kilbride HW. Evidence-based approach to change in clinical practice: introduction of expanded nasal continuous positive airway pressure use in an intensive care nursery. Pediatrics. 2003;111(4 pt 2). Available at: www. pediatrics. org/ cgi/ content/ full/ 111/ 4/ e542
Kulkarni A, Ehrenkranz RA, Bhandari V. Effect of introduction of synchronized nasal intermittent positive-pressure ventilation in a neonatal intensive care unit on bronchopulmonary dysplasia and growth in preterm infants. Am J Perinatol. 2006;23(4):233–240
Lampland AL, Plumm B, Meyers PA, Worwa CT, Mammel MC. Observational study of humidifi ed high-fl ow nasal cannula compared with nasal continuous positive airway pressure. J Pediatr. 2009;154(2):177– 82
Manzar S, Nair AK, Pai MG, et al. Use of nasal intermittent positive pressure ventilation to avoid intubation in neonates. Saudi Med J. 2004;25(10):1464–1467
Salama GSA, Alhadidi A, Ayyash FF, Khlefat A, Al Twall ES. Nasal SIMV as an initial mode of respiratory support for premature infants with RDS. An observational study. Mid East J Med. 2012;5(4):17–23
Santin R, Brodsky N, Bhandari V. A prospective observational pilot study of synchronized nasal intermittent positive pressure ventilation (SNIPPV) as a primary mode of ventilation in infants > or = 28 weeks with respiratory distress syndrome (RDS). J Perinatol. 2004;24(8):487–493
Saslow JG, Aghai ZH, Nakhla TA, et al. Work of breathing using high-fl ow nasal cannula in preterm infants. J Perinatol. 2006;26(8):476–480
Sun S, Tero R. Safety and effi cacy of the Vapotherm 2000i in the neonatal population. Respir Care. 2004;49(11):1384
Colaizy TT, Younis UM, Bell EF, Klein JM. Nasal high-frequency ventilation for premature infants. Acta Paediatr. 2008;97(11):1518–1522
Roberts CT, Davis PG, Owen LS. Neonatal non-invasive respiratory support: synchronised NIPPV, nonsynchronised NIPPV or bi-level CPAP: what is the evidence in 2013? Neonatology. 2013;104(3):203–209
Sai Sunil Kishore M, Dutta S, Kumar P. Early nasal intermittent positive pressure ventilation versus continuous positive airway pressure for respiratory distress syndrome. Acta Paediatr. 2009;98(9):1412–1415
Terzi N, Piquilloud L, Rozé H, et al. Clinical review: Update on neurally adjusted ventilatory assist--report of a round-table conference. Crit Care. 2012;16(3):225
Lee J, Kim HS, Sohn JA, et al. Randomized crossover study of neurally adjusted ventilatory assist in preterm infants. J Pediatr. 2012;161(5):808–813
Moretti C, Giannini L, Fassi C, Gizzi C, Papoff P, Colarizi P. Nasal fl owsynchronized intermittent positive pressure ventilation to facilitate weaning in very low-birthweight infants: unmasked randomized controlled trial. Pediatr Int. 2008;50(1):85–91
Kugelman A, Feferkorn I, Riskin A, Chistyakov I, Kaufman B, Bader D. Nasal intermittent mandatory ventilation versus nasal continuous positive airway pressure for respiratory distress syndrome: a randomized, controlled, prospective study. J Pediatr. 2007;150(5):521–526, 526.e1
Aghai ZH, Saslow JG, Nakhla T, et al. Synchronized nasal intermittent positive pressure ventilation (SNIPPV) decreases work of breathing (WOB) in premature infants with respiratory distress syndrome (RDS) compared to nasal continuous positive airway pressure (NCPAP). Pediatr Pulmonol. 2006;41(9):875–881
Ali N, Claure N, Alegria X, D’Ugard C, Organero R, Bancalari E. Effects of noninvasive pressure support ventilation (NI-PSV) on ventilation and respiratory effort in very low birth weight infants. Pediatr Pulmonol. 2007;42(8):704–710
Lampland AL, Meyers PA, Worwa CT, Swanson EC, Mammel MC. Gas exchange and lung infl ammation using nasal intermittent positive-pressure ventilation versus synchronized intermittent mandatory ventilation in piglets with saline lavage-induced lung injury: an observational study. Crit Care Med. 2008;36(1):183–187
Kiciman NM, Andréasson B, Bernstein G, et al. Thoracoabdominal motion in newborns during ventilation delivered by endotracheal tube or nasal prongs. Pediatr Pulmonol. 1998;25(3):175–181
Moretti C, Gizzi C, Papoff P, et al. Comparing the effects of nasal synchronized intermittent positive pressure ventilation (nSIPPV) and nasal continuous positive airway pressure (nCPAP) after extubation in very low birth weight infants. Early Hum Dev. 1999;56(2-3):167–177
Chang HY, Claure N, D’ugard C, Torres J, Nwajei P, Bancalari E. Effects of synchronization during nasal ventilation in clinically stable preterm infants. Pediatr Res. 2011;69(1):84–89
Owen LS, Morley CJ, Dawson JA, Davis PG. Effects of non-synchronised nasal intermittent positive pressure ventilation on spontaneous breathing in preterm infants. Arch Dis Child Fetal Neonatal Ed. 2011;96(6) F422–F428
Owen LS, Morley CJ, Davis PG. Pressure variation during ventilator generated nasal intermittent positive pressure ventilation in preterm infants. Arch Dis Child Fetal Neonatal Ed. 2010;95(5):F359–F364
Miedema M, van der Burg PS, Beuger S, de Jongh FH, Frerichs I, van Kaam AH. Effect of nasal continuous and biphasic positive airway pressure on lung volume in preterm infants. J Pediatr. 2013;162(4):691– 97
Migliori C, Motta M, Angeli A, Chirico G. Nasal bilevel vs. continuous positive airway pressure in preterm infants. Pediatr Pulmonol. 2005;40(5): 426–430
Lin CH, Wang ST, Lin YJ, Yeh TF. Effi cacy of nasal intermittent positive pressure ventilation in treating apnea of prematurity. Pediatr Pulmonol. 1998;26(5):349–353
Pantalitschka T, Sievers J, Urschitz MS, Herberts T, Reher C, Poets CF. Randomised crossover trial of four nasal respiratory support systems for apnoea of prematurity in very low birthweight infants. Arch Dis Child Fetal Neonatal Ed. 2009;94(4):F245–F248
Ryan CA, Finer NN, Peters KL. Nasal intermittent positive-pressure ventilation offers no advantages over nasal continuous positive airway pressure in apnea of prematurity. Am J Dis Child. 1989;143(10):1196– 198
Gao WW, Tan SZ, Chen YB, Zhang Y, Wang Y. [Randomized trail of nasal synchronized intermittent mandatory ventilation compared with nasal continuous positive airway pressure in preterm infants with respiratory distress syndrome]. Zhongguo Dang Dai Er Ke Za Zhi. 2010;12(7):524–526
Barrington KJ, Bull D, Finer NN. Randomized trial of nasal synchronized intermittent mandatory ventilation compared with continuous positive airway pressure after extubation of very low birth weight infants. Pediatrics. 2001;107(4):638–641
Friedlich P, Lecart C, Posen R, Ramicone E, Chan L, Ramanathan R. A randomized trial of nasopharyngealsynchronized intermittent mandatory ventilation versus nasopharyngeal continuous positive airway pressure in very low birth weight infants after extubation. J Perinatol. 1999;19(6 pt 1):413–418
Khalaf MN, Brodsky N, Hurley J, Bhandari V. A prospective randomized, controlled trial comparing synchronized nasal intermittent positive pressure ventilation versus nasal continuous positive airway pressure as modes of extubation. Pediatrics. 2001;108(1):13–17
Khorana M, Paradeevisut H, Sangtawesin V, Kanjanapatanakul W, Chotigeat U, Ayutthaya JK. A randomized trial of non-synchronized Nasopharyngeal Intermittent Mandatory Ventilation (nsNIMV) vs. Nasal Continuous Positive Airway Pressure (NCPAP) in the prevention of extubation failure in pre-term < 1,500 grams. J Med Assoc Thai. 2008;91(3 suppl 3):S136–S142
Kirpalani H, Millar D, Lemyre B, Yoder BA, Chiu A, Roberts RS; NIPPV Study Group. A trial comparing noninvasive ventilation strategies in preterm infants. N Engl J Med. 2013;369(7):611–620
O’Brien K, Campbell C, Brown L, Wenger L, Shah V. Infant fl ow biphasic nasal continuous positive airway pressure (BP- NCPAP) vs. infant fl ow NCPAP for the facilitation of extubation in infants’ ≤ 1,250 grams: a randomized controlled trial. BMC Pediatr. 2012;12:43
Ramanathan R, Sekar KC, Rasmussen M, Bhatia J, Soll RF. Nasal intermittent positive pressure ventilation after surfactant treatment for respiratory distress syndrome in preterm infants <30 weeks’ gestation: a randomized, controlled trial. J Perinatol. 2012;32(5):336–343
Bisceglia M, Belcastro A, Poerio V, etal. A comparison of nasal intermittent versus continuous positive pressuredelivery for the treatment ofmoderate respiratory syndrome inpreterm infants. Minerva Pediatr.2007;59(2):91–95
Meneses J, Bhandari V, Alves JG, Herrmann D. Noninvasive ventilation for respiratory distress syndrome: a randomized controlled trial. Pediatrics. 2011;127(2):300–307
Shi Y, Tang S, Zhao J, Shen J. A prospective, randomized, controlledstudy of NIPPV versus nCPAP inpreterm and term infants withrespiratory distress syndrome. PediatrPulmonol. 2014;49(7):673–678
Bahadue FL, Soll R. Early versus delayed selective surfactant treatmentfor neonatal respiratory distresssyndrome. Cochrane Database SystRev. 2012;11(11):CD001456
Bancalari E, Claure N. The evidence for non-invasive ventilation in the preterm infant. Arch Dis Child Fetal Neonatal Ed.2013;98(2):F98–F102
Bhandari V. Nasal intermittentpositive pressure ventilation in thenewborn: review of literature and evidence-based guidelines. J Perinatol.2010;30(8):505–512
Bhandari V. Noninvasive respiratory support in the preterm infant. Clin Perinatol. 2012;39(3):497–511
Hutchison AA, Bignall S. Non-invasive positive pressure ventilation in the preterm neonate: reducing endotrauma and the incidence of bronchopulmonary dysplasia. Arch Dis Child Fetal Neonatal Ed. 2008;93(1) F64–F68
Mahmoud RA, Roehr CC, Schmalisch G. Current methods of noninvasive ventilatory support for neonates. Paediatr Respir Rev. 2011;12(3):196–205
Meneses J, Bhandari V, Alves JG. Nasal intermittent positive-pressure ventilation vs nasal continuous positive airway pressure for preterm infants with respiratory distress syndrome: a systematic review and metaanalysis. Arch Pediatr Adolesc Med. 2012;166(4):372–376
Tang S, Zhao J, Shen J, Hu Z, Shi Y. Nasal intermittent positive pressure ventilation versus nasal continuous positive airway pressure in neonates: a systematic review and meta-analysis. Indian Pediatr. 2013;50(4) 371–376
Wood FE, Gupta S, Tin W, Sinha S. G170: randomised controlled trial of synchronised intermittent positive airway pressure (SiPAP) versus continuous positive airway pressure (CPAP) as a primary mode of respiratory support in preterm infants with respiratory distress syndrome. Arch Dis Child. 2013;98(supp1):A78
Lista G, Castoldi F, Fontana P, et al. Nasal continuous positive airway pressure (CPAP) versus bi-level nasal CPAP in preterm babies with respiratory distress syndrome: a randomised control trial. Arch Dis Child Fetal Neonatal Ed. 2010;95(2):F85–F89
Kopelman AE. Airway obstruction in two extremely low birthweight infants treated with oxygen cannulas. J Perinatol. 2003;23(2):164–165
Kopelman AE, Holbert D. Use of oxygen cannulas in extremely low birthweight infants is associated with mucosal trauma and bleeding, and possibly with coagulase-negative staphylococcal sepsis. J Perinatol. 2003;23(2):94–97
Woodhead DD, Lambert DK, Clark JM, Christensen RD. Comparing two methods of delivering highfl ow gas therapy by nasal cannula following endotracheal extubation: a prospective, randomized, masked, crossover trial. J Perinatol. 2006;26(8):481–485
Dysart K, Miller TL, Wolfson MR, Shaffer TH. Research in high fl ow therapy: mechanisms of action. Respir Med. 2009;103(10):1400–1405
Frizzola M, Miller TL, Rodriguez ME, et al. High-fl ow nasal cannula: impact on oxygenation and ventilation in an acute lung injury model. Pediatr Pulmonol. 2011;46(1):67–74
Locke RG, Wolfson MR, Shaffer TH, Rubenstein SD, Greenspan JS. Inadvertent administration of positive end-distending pressure during nasal cannula fl ow. Pediatrics. 1993;91(1):135–138
Sreenan C, Lemke RP, Hudson- Mason A, Osiovich H. High-fl ow nasal cannulae in the management of apnea of prematurity: a comparison with conventional nasal continuous positive airway pressure. Pediatrics. 2001;107(5):1081–1083
Arora B, Mahajan P, Zidan MA, Sethuraman U. Nasopharyngeal airway pressures in bronchiolitis patients treated with high-fl ow nasal cannula oxygen therapy. Pediatr Emerg Care. 2012;28(11):1179–1184
Collins CL, Holberton JR, König K. Comparison of the pharyngeal pressure provided by two heated, humidifi ed high-fl ow nasal cannulae devices in premature infants. J Paediatr Child Health. 2013;49(7):554–556
Dani C, Pratesi S, Migliori C, Bertini G. High fl ow nasal cannula therapy as respiratory support in the preterm infant. Pediatr Pulmonol. 2009;44(7):629–634
de Klerk A. Humidifi ed high-fl ow nasal cannula: is it the new and improved CPAP? Adv Neonatal Care. 2008;8(2):98–106
Haq I, Gopalakaje S, Fenton AC, McKean MC, J O’Brien C, Brodlie M. The evidence for high fl ow nasal cannula devices in infants. Paediatr Respir Rev. 2014;15(2):124–134
Hasan RA, Habib RH. Effects of flow rate and airleak at the nares and mouth opening on positive distending pressure delivery using commercially available high-fl ow nasal cannula systems: a lung model study. Pediatr Crit Care Med. 2011;12(1):e29–e33
Kubicka ZJ, Limauro J, Darnall RA. Heated, humidifi ed high-fl ow nasal cannula therapy: yet another way to deliver continuous positive airway pressure? Pediatrics. 2008;121(1):82–88
Lee JH, Rehder KJ, Williford L, Cheifetz IM, Turner DA. Use of high fl ow nasal cannula in critically ill infants, children, and adults: a critical review of the literature. Intensive Care Med. 2013;39(2):247–257
Manley BJ, Dold SK, Davis PG, Roehr CC. High-fl ow nasal cannulae for respiratory support of preterm infants: a review of the evidence. Neonatology. 2012;102(4):300–308
Shaffer TH, Alapati D, Greenspan JS, Wolfson MR. Neonatal non-invasive respiratory support: physiological implications. Pediatr Pulmonol. 2012;47(9):837–847
Sivieri EM, Gerdes JS, Abbasi S. Effect of HFNC fl ow rate, cannula size, and nares diameter on generated airway pressures: an in vitro study. Pediatr Pulmonol. 2013;48(5):506–514
Spence KL, Murphy D, Kilian C, McGonigle R, Kilani RA. High-fl ow nasal cannula as a device to provide continuous positive airway pressure in infants. J Perinatol. 2007;27(12):772–775
Volsko TA, Fedor K, Amadei J, Chatburn RL. High fl ow through a nasal cannula and CPAP effect in a simulated infant model. Respir Care. 2011;56(12):1893–1900
Ward JJ. High-fl ow oxygen administration by nasal cannula for adult and perinatal patients. Respir Care. 2013;58(1):98–122
Wilkinson DJ, Andersen CC, Smith K, Holberton J. Pharyngeal pressure with high-fl ow nasal cannulae in premature infants. J Perinatol. 2008;28(1):42–47
Ovalle O, Gomez T, Troncoso G, Palacios J, Ortiz E. High fl ow nasal cannula after surfactant treatment for infant respiratory distress syndrome in preterm infants < 30 weeks [abstr]. E-PAS. 2005;57:3417. Available at: www. abstracts2view. com/ pasall/ view. php? nu= PAS5L1_ 1804. Accessed February 10, 2015
Campbell DM, Shah PS, Shah V, Kelly EN. Nasal continuous positive airway pressure from high fl ow cannula versus Infant Flow for Preterm infants. J Perinatol. 2006;26(9):546–549
Collins CL, Holberton JR, Barfi eld C, Davis PG. A randomized controlled trial to compare heated humidifi ed high-fl ow nasal cannulae with nasal continuous positive airway pressure postextubation in premature infants. J Pediatr. 2013;162(5):949–954
Joshi R, Rajhans A, Patil S, Dominic S, Phadtare R, Devaskar U. High fl ow oxygen in neonatal respiratory failure: is it better than CPAP? [abstr]. E-PAS. 2008;63:3768.11. Available at: www. abstracts2view. com/ pasall/ view. php? nu= PAS08L1_ 2027. Accessed February 10, 2015
Klingenberg C, Pettersen M, Hansen EA, et al. Patient comfort during treatment with heated humidifi ed high fl ow nasal cannulae versus nasal continuous positive airway pressure: a randomised cross-over trial. Arch Dis Child Fetal Neonatal Ed. 2014;99(2):F134–F137
Lavizzari A, Ciuffi ni F, Colnaghi M, et al. High fl ow nasal cannula versus nasal CPAP in the management of respiratory distress syndrome: preliminary data [abstr]. E-PAS. 2013:4515.262. Available at: www. abstracts2view. com/ pasall/ view. php? nu= PAS13L1_ 4515. 262. Accessed February 10, 2015
Manley BJ, Owen LS, Doyle LW, et al. High-fl ow nasal cannulae in very preterm infants after extubation. N Engl J Med. 2013;369(15):1425– 1433
Nair G, Karna P. Comparison of the effects of Vapotherm and nasal CPAP in respiratory distress in preterm infants [abstr]. E-PAS. 2005;57:2054. Available at: www. abstracts2view. com/ pasall/ view. php? nu= PAS5L1_ 1667. Accessed February 10, 2015
Yoder BA, Stoddard RA, Li M, King J, Dirnberger DR, Abbasi S. Heated, humidifi ed high-fl ow nasal cannula versus nasal CPAP for respiratory support in neonates. Pediatrics. 2013;131(5). Available at: www. pediatrics. org/ cgi/ content/ full/ 131/ 5/ e1482
Osman M, Elsharkawy A, Abdel-Hady H. Assessment of pain during application of nasal-continuous positive airway pressure and heated, humidifi ed high-fl ow nasal cannulae in preterm infants. J Perinatol. 2015;35(4):263–267 10.1038/jp.2014.206
Stevens B, Johnston C, Petryshen P, Taddio A. Premature Infant Pain Profi le: development and initial validation.Clin J Pain. 1996;12(1):13–22
Roberts CT, Manley BJ, Dawson JA, Davis PG. Nursing perceptions of highfl ow nasal cannulae treatment for very preterm infants. J Paediatr Child Health. 2014;50(10):806–810
Wilkinson D, Andersen C, O’Donnell CP, De Paoli AG. High fl ow nasal cannula for respiratory support in preterm infants. Cochrane Database Syst Rev. 2011; (5):CD006405
Miller SM, Dowd SA. High-fl ow nasal cannula and extubation success in the premature infant: a comparison of two modalities. J Perinatol. 2010;30(12):805–808
Hegde S, Prodhan P. Serious air leak syndrome complicating high-fl ow nasal cannula therapy: a report of 3 cases. Pediatrics. 2013;131(3). Available at: www. pediatrics. org/ cgi/ content/ full/ 131/ 3/ e939
Jasin LR, Kern S, Thompson S, Walter C, Rone JM, Yohannan MD. Subcutaneous scalp emphysema, pneumo-orbitis and pneumocephalus in a neonate on high humidity high fl ow nasal cannula. J Perinatol. 2008;28(11):779–781