Alimentación del Prematuro
Febrero 2012
Alimentación de los prematuros : porqué, cuando y qué agregar a la leche materna.
Ronald S. Cohen, MD; and Katherine R. McCallie,MD
From Lucile S. Packard Children’s Hospital, Stanford University, Palo Alto, California.
JPEN J Parenter Enteral Nutr Enero 2012, 36: 20S
Traducción libre Dr Gerardo Flores Henríquez Pediatra Neonatólogo Puerto Montt Chile
En esta revisión,
se discuten 3
preguntas importantes para
los que cuidan a
los neonatos prematuros
:
1.
¿Pueden los requerimientos
nutricionales
de
los neonatos prematuros
en crecimiento
ser cumplidos por la leche
humana?
2.
¿Podemos decir
que
estas necesidades
no se están cumpliendo?
3.
¿Se puede
añadir algo a
la leche materna
para ayudar a satisfacer
estas necesidades?
Es generalmente aceptado que la leche humana es la base preferida de nutrición para los niños humanos, incluyendo los nacidos prematuramente.1-4 Sin embargo, está claro que todavía tenemos importantes problemas para proporcionar soporte nutricional completo adecuado para los recién nacidos de muy bajo peso al nacer, definidos como peso de 1.500 gramos ó menos al nacer.
El problema de la restricción del crecimiento extrauterino (EUGR) sigue siendo común en nuestras unidades de cuidados intensivos neonatales (UCIN), 5 con importantes consecuencias para outcomes a largo plazo.6 Esto es especialmente importante para los neonatos de extremo bajo peso al nacer (EBPN) que nacen con un peso ≤ 1.000 g . Radmacher y cols.5 mostraron que el 59% de los neonatos de EBPN que desarrollan EUGR comienzan más pequeños, tienen más días de nutrición parenteral y se alimentan más tardíamente que sus compañeros de más rápido crecimiento. Los datos de los National Institutes of Health Neonatal Research Network 7 muestran que al momento del alta, el peso promedio de los RN nacidos entre 24 y 29 semanas de edad gestacional estaba por debajo del percentil 10 para peso de nacimiento esperado para su edad gestacional corregida.
Esta EUGR (RCEU ó restricción de crecimiento extrauterino) tiene importantes implicaciones, tanto a corto como a largo plazo. Estos niños de EBPN cuyo crecimiento está en el cuartil más lento durante su estadía en la UCIN tienen tasas de enterocolitis necrotizante (NEC), sepsis de aparición tardía y displasia broncopulmonar significativamente aumentadas en comparación con los cuartiles de crecimiento más rápido.6 A los 18 - 22 meses de edad postmenstrual, estos mismos bebés tienen un outcome peor que los grupos de comparación de mejor crecimiento, con tasas significativamente más altas de trastornos del neurodesarrollo, incluyendo parálisis cerebral y retraso del desarrollo. Por lo tanto, el manejo nutricional precoz puede tener implicaciones importantes para el outcome de neonatos prematuros, en particular los niños de EBPN.
Si aceptamos la evidencia de los efectos nocivos de una nutrición inadecuada en los niños prematuros, la siguiente pregunta es, ¿qué evidencia existe para sugerir que las intervenciones nutricionales tempranas pueden tener un impacto beneficioso sobre los outcomes ? .
Los datos apoyan proporcionar más proteína a los neonatos prematuros en los primeros momentos de la vida. Stephens y cols8 demostraron que cada 1 g / kg de proteína adicional proporcionada en la primera semana de vida se asocia con 8,2 puntos más alto de Mental Development Index score (MDI) en las Bayley Scales of Infant Development a los 18 meses de edad postmenstrual.
Con aumento en el aporte parenteral de aminoácidos, no hubo relación entre la dosis de proteínas y los niveles de nitrógeno ureico en sangre (BUN).9 Entre 2 grupos de niños prematuros en crecimiento alimentados enteralmente con el mismo aporte calórico total pero con diferentes contenidos de proteína, la dieta con mayor proteína (4,6 g / kg / día) produjo una ganancia de peso significativamente mejor que la dieta más baja en proteínas (3,8 g / kg / día).10 Aunque la dieta con proteína más alta resultó en un BUN ligeramente más alto, los niveles seguían siendo < 20 mg / dL y no había acidosis metabólica. Un reciente estudio de fórmulas de alto contenido proteico confirmó mejor crecimiento con aporte aumentado de proteínas (3,5 g por 100 kcal) a pesar del aporte total de líquidos y calorías más bajo.11
Se plantea así la pregunta, puede la leche humana proporcionar aporte adecuado de proteínas para los pacientes prematuros en UCIN ? Por el bien del argumento, asumamos que el contenido de proteína de la leche humana es 1,2 g / dL,12-14 tal vez una estimación un tanto optimista.15 En este escenario del mejor caso, un aporte de 160 ml / kg / día se traduciría en un aporte proteico de sólo 1,9 g / kg de proteína por día, muy por debajo del aporte proteico en los estudios anteriormente mencionados. Se necesitaría una ingesta diaria de 250 ml / kg para llegar a un aporte proteico mínimo de 3 g / kg / día. Lograr 4 g / kg de proteína diariamente con una dieta de leche materna sóla sería imposible. La situación es aún peor si hay un déficit de proteínas preexistente debido a un período prolongado sin nutrición enteral y nutrición por vía intravenosa, con cantidades inadecuadas de aminoácidos.
Así, el primer paso para asegurar nutrición proteica adecuada para prematuros es comenzar hiperalimentación con 2,5-3,5 g / kg /día de aminoácidos tan pronto como sea posible, preferiblemente dentro de horas después del nacimiento.16,17 El segundo paso es comenzar la nutrición enteral tan pronto como sea médicamente factible. La vieja teoría de que un retraso prolongado en el inicio de las alimentaciones previene la NEC ha sido en gran parte desacreditada.18,19 Lo que ha demostrado ser eficaz es la aplicación de un protocolo de alimentación práctico que promueve el inicio precoz de nutrición enteral, permitir una velocidad razonable de avance de la alimentación e incluye monitoreo adecuado de la tolerancia alimentaria y status metabólico.19-21
Después de proporcionar nutrición parenteral adecuada e iniciar y establecer alimentación enteral con leche humana, ¿cómo podemos hacer frente a los datos que indican que la leche materna sola no proporciona nutrición proteica adecuada?
La respuesta "fácil" es la fortificación, pero con qué y cuándo? Los fortificantes en polvo estándar pueden no proporcionar suficientes proteínas, 22,23 y algunos han sugerido que estos están asociados con un mayor riesgo de NEC.24 Fortificantes líquidos más recientes han aumentado la cantidad de proteína, llegando hasta 4 g de proteínas por 100 kcal cuando se usan para añadir 4 kcal / oz a la leche humana.25 Esto proporcionaría 4,8 g / kg de proteína diariamente si se indican 120 kcal / kg por día.
Otra potencial respuesta es un nuevo fortificante derivado de la leche humana. Los primeros datos de este producto son tranquilizadores, mostrando buena tolerancia con una incidencia muy baja de NEC.26 Este producto añade 1.2, 1.8 ó 2.0 g de proteína por cada 100 ml, dependiendo de si va a agregar 4, 6, u 8 kcal por onza.27 En cualquiera de las dos concentraciones más altas, asumiendo de nuevo que el contenido de proteína en la leche humana es 1,2 g / dL , se proporcionan > 3 g / kg de proteína diariamente a un prematuro alimentándose con ≥ 160 ml / kg / día . Parece que los prematuros toleran bien este fortificante derivado de la leche humana y que estos niveles más altos de fortificación se pueden conseguir sin dificultad. También se pueden utilizar mayores volúmenes totales de alimentación a menos que exista una fuerte contraindicación médica, por lo general incrementos de aporte hasta 180 ml / kg/ día e incluso hasta 200 ml / kg al día si es necesario.
El ajuste de fortificación basado en los niveles de BUN también ha sido descrito.28 Al aumentar la cantidad de proteína en la dieta, hasta que el BUN permanezca dentro de límites aceptables, se reportó mejor ganancia de peso y crecimiento cefálico. Los mismos autores han mostrado que el aporte proteico para prematuros alimentados con leche humana fortificada son más bajos que los esperados.22 Por desgracia, muy pocas UCIN tienen la capacidad de analizar la leche en el momento oportuno y por lo tanto modificar la fortificación. Aunque esto pudiera ser hecho, las muestras analizadas pueden no representar el promedio de leche producida por la madre a través del tiempo. El contenido nutritivo de la leche humana no sólo varía a lo largo de la lactancia, sino también a lo largo del día e incluso durante una alimentación al pecho.29-31 No obstante, estas estrategias pueden resultar en aporte proteico significativamente mejor que el logrado previamente , así como tasas de crecimiento similares a los niveles intrauterino.
Al momento del alta hospitalaria, los prematuros por lo general se alimentan ad libitum con buena ingesta de volumen total. Si suponemos que la nutrición se ha hecho bien como se describe anteriormente, el siguiente paso consiste en determinar el régimen de nutrición en casa. Las fórmulas post alta más recientes para prematuros alimentados con fórmula prematuros parecen seguras y eficaces. Sin embargo, el rol de fórmulas y suplementos especiales posteriores al alta para el egresado de UCIN alimentándose al pecho sigue siendo no clara.32
Un estudio reciente33 sugiere que la fortificación postalta es posible sin interferir excesivamente con la lactancia, pero que puede ser no necesaria ó incluso no eficaz. Ni la leche materna fortificada ni las fórmula para prematuros, en comparación con una dieta de leche materna no fortificada, afectó significativamente el outcome de crecimiento al 1 año. Otro estudio reportó mayor ganancia de peso y mayor contenido mineral óseo al 1 año en los bebés alimentados con leche fortificada en comparación con los controles alimentados con leche sin fortificar.34 Sin embargo, no hubo diferencia en la densidad mineral ósea ni en la circunferencia cefálica, con una tendencia hacia menos ingesta de leche humana en el grupo fortificado. Asumiento que la ingesta de calorías aumentada, sea con fortificante ó fórmula podría resultar en mayor ganancia de peso en el primer año de vida, permanece la pregunta de si ésto es realmente deseable. Hay un creciente volumen de literatura que sugiere que el aumento de peso demasiado rápido durante el primer año de vida puede ser perjudicial. Más ganancia de peso postnatal precoz desde el nacimiento hasta los 3 meses postérmino y durante el primer año de vida en los recién nacidos < 32 semanas de gestación se ha correlacionado con un mayor porcentaje de grasa corporal y más distribución de grasa abdominal a la edad de 19 años.35 El rápido crecimiento en la infancia también se ha asociado con un mayor riesgo de enfermedad cardiovascular, hipertensión, obesidad y diabetes tipo 2 en la vida adulta.36,37 Fortificar la leche humana para tratar de lograr crecimiento similar a las tasas intrauterinas mientras esté en la UCIN parece razonable. Sin embargo, dados los conocidos beneficios de la leche humana, para la mayoría de los egresados de la UCIN debe haber una indicación clara y fuerte antes de cambiar una dieta de alimentación con leche materna a cualquier otra alternativa.
La siguiente área a tratar es la ingesta de calcio-fósforo. El así llamado raquitismo de la prematuridad sigue siendo un tema de preocupación.38,39 La ingesta enteral de calcio y fósforo en prematuros alimentados con leche humana sola es sin duda menor que las tasas de acreción intrauterinas y probablemente inadecuados para cumplir la demanda.40 Los aportes recomendados varían de manera significativa.
Las recomendaciones europeas 41 Europeas son 50-140 mg de calcio y 25-90 mg de fósforo, mientras que las recomendaciones Americanas42 son 67-200 mg de calcio y 40-127 mg de fósforo por cada 100 kcal de ingesta (ver Tabla 1).
Table 1. Recommended Enteral Calcium and Phosphorus Intakes for Premature Infants, mg/100 kcal
| AAP | ESPGHAN | |
| Calcium | 67–200 | 50–140 |
| Phosphorus | 40–127 | 25–90 |
| AAP, American Academy of Pediatrics; ESPGHAN, European Society of Paediatric Gastroenterology, Hepatology and Nutrition. | ||
La leche humana no se acerca. Las estimaciones varían, pero probablemente no hay más de 45 mg de calcio y 25 mg de fósforo por cada 100 kcal de leche humana.32,43 Incluso con suplementación, los números son totalmente inadecuados.32,44
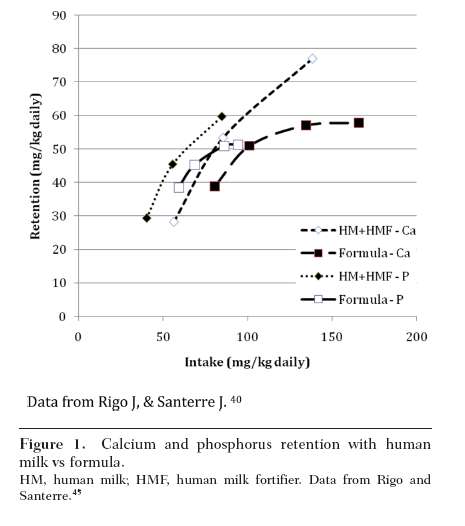
Sin embargo, la biodisponibilidad de calcio y fósforo en la leche humana es mucho mayor que con la fórmula. Para el calcio, hay cerca de 60% de absorción neta desde la leche humana fortificada, pero < 50% de absorción neta desde la fórmula, con una fracción más pequeña absorbida cuando aumenta el aporte de calcio a través de fórmula. Del mismo modo, para el fósforo, más del 90% de absorción neta se ve con leche humana fortificada, pero como el aporte de fósforo aumenta a través de fórmula, la absorción neta cae por debajo de 70% 45 (ver Figura 1).

¿Podemos identificar
a los prematuros en
crecimiento que
no están recibiendo
suficiente calcio
o fosfato
en su dieta?
Varios métodos han sido propuestos para monitorizar el status de desarrollo óseo en prematuros en la UCIN. Por lo general, los niveles de fosfatasa alcalina (ALP) se han utilizado. Sin embargo, esta enzima también deriva de otros órganos además de los huesos, tales como intestino e hígado.44,46 La isoforma ósea de ALP deriva de osteoblastos y es un marcador para formación ósea47, por lo que puede estar significativamente elevada con el crecimiento óseo.44 Los niveles extremadamente altos de ALP (> 1200 UI / L) se mostraron (hace 20 años) que se correlacionan con longitud corporal disminuída.48 Sin embargo, niveles similares pueden verse en hiperfosfatemia benigna transitoria.49 Elevaciones marcadas en los niveles de fosfatasa alcalina se observan rara vez en nuestra UCIN hoy en día, y el valor predictivo de los niveles elevados de fosfatasa alcalina es muy cuestionable.50 De este modo, se ha argumentado que los niveles de calcio y fósforo en la orina pueden ser mejores marcadores de la adecuación de la ingesta de estos minerals.40,44 Aunque la leche materna puede ser baja en calcio y fósforo , hay pocos datos para sugerir mejores alternativas. Como se señaló anteriormente, mayor aporte de calcio-fosfato no significa necesariamente cantidades más altas de absorción de minerales.
Los datos sugieren "que la suplementación mineral en los prematuros durante la hospitalización no mejora significativamente el outcome de mineralización ósea al término si los niños se alimentan con 200 ml por kg por día" de lactancia materna.51 Los resultados del seguimiento a largo plazo son similares. Los datos de una cohorte británica seguido por más de 20 años 52 indican que, incluso con fórmula y suplementación , el aporte mineral era inferior a lo adecuado. Sin embargo, los mayores contenidos minerales óseos eran de aquellos que recibieron la mayoría de leche humana en su dieta. De hecho, aunque más leche humana en la dieta significó un aporte inicial más bajo de calcio-fósforo, dió lugar a un mayor contenido mineral óseo en el seguimiento a largo plazo. Además, en este estudio, la suplementación de la leche materna con leche de banco resultó en un mayor contenido mineral óseo en el seguimiento a largo plazo que si se suplementaba con fórmula. Al poner estos datos en conjunto da como resultado un argumento legítimo para maximizar la ingesta de leche materna para los prematuros.
Volvamos
a las preguntas
planteadas al inicio:
1.
¿Pueden los requerimientos
nutricionales
de
los prematuros
en crecimiento
ser cumplidos por la leche
humana?
2.
¿Podemos decir
que
estas necesidades
no se están cumpliendo?
3.
¿Podemos
ofrecer algo
mejor que la leche
humana
para ayudar a satisfacer
estas necesidades?
La leche humana, aunque inadecuada para satisfacer los requerimientos proteicos precoces de los niños prematuros, puede proporcionar una nutrición adecuada para estos niños, cuando están cerca del alta hospitalaria y más allá. Proporcionar proteína aumentada precozmente en la estadía en la UCIN puede prevenir restricción de crecimiento extrauterino (EUGR) y déficits nutricionales. El beneficio después del alta para el crecimiento de la leche materna fortificada ó fórmula pretérmino con respecto a una dieta de leche humana sin fortificar todavía no se ha establecido completamente.
Aunque las deficiencias de calcio y fosfato son difíciles de diagnosticar en los prematuros en crecimiento, la leche materna tiene la ventaja de biodisponibilidad aumentada de estos minerales. Los datos muestran un mayor contenido mineral óseo en el seguimiento a largo plazo con una mayor ingesta de leche materna durante el período postnatal. Además, el rápido catch-up de crecimiento postnatal que ofrece el aumento de aporte calórico puede en realidad aumentar el riesgo de enfermedades cardiovasculares, hipertensión, obesidad y diabetes tipo 2 en la vida adulta.
Por lo tanto, los recién nacidos prematuros se benefician de minimizar sus déficits precoces de proteínas, tanto por vía parenteral y enteral, disminuyendo el grado de restricción de crecimiento extrauterino en el hospital, eliminando la necesidad de un rápido crecimiento de recuperación (catch-up growth) en el período cercano al alta y postalta y maximizando su ingesta de leche materna para satisfacer sus necesidades nutricionales.
Referencias
Boyd CA, Quigley A, Brocklehurst P. Donor breast milk versus infant formula for preterm infants: systematic review and metaanalysis. Arch Dis Child Fetal Neonatal Ed. 2007;92:F169-F175.
Chauhan, M, Henderson, G, Mcguire, W. Enteral feeding for very low birth weight infants: reducing the risk of necrotising enterocolitis. Arch Dis Child Fetal Neonatal Ed. 2008;93:F162-F166.
Bertino E, Giuliani F, Occhi L, et al. Benefits of donor human milk for preterm infants: current evidence. Early Hum Dev. 2009;85:S9-S10.
Arslanoglu S, Ziegler EE, Moro GE. Donor human milk in preterm infant feeding: evidence and recommendations. J Perinat Med. 2010;38:347-351.
Radmacher PG, Looney SW, Rafail ST, Adamkin DH. Prediction of extrauterine growth retardation (EUGR) in VVLBW infants. J Perinatol. 2003;23:392-395.
Ehrenkranz RA, Dusick AM, Vohr BR, et al. Growth in the neonatal intensive care unit influences neurodevelopmental and growth outcomes of extremely low birth weight infants. Pediatrics. 2006;117:1253-1261.
Ehrenkranz RA, Younes N, Lemons JA, et al. Longitudinal growth of hospitalized very low birth weight infants. Pediatrics. 1999;104:280-289.
Stephens BE, Walden RV, Gargus RA, et al. First-week protein and energy intakes are associated with 18-month developmental outcomes in extremely low birth weight infants. Pediatrics. 2009;123:1337-1343.
Ridout E, Melara D, Rottinghaus S, Thureen PJ. Blood urea nitrogen concentration as a marker of amino-acid intolerance in neonates with birthweight less than 1250 g. J Perinatol. 2005;25:130-133.
Cooke R, Embleton N, Rigo J, Carrie A, Haschke F, Ziegler E. High protein pre-term infant formula: effect on nutrient balance, metabolic status and growth. Pediatr Res. 2006;59:265-270.
Fanaro S, Bellardini E, Vigi V. Different pre-term formulas for different pre-term infants. Early Hum Dev. 2010;86:S27-S31.
Nommsen LA, Lovelady CA, Heinig MJ, Lönnerdal B, Dewey KG. Determinants of energy, protein, lipid, and lactose concentrations in human milk during the first 12 mo of lactation: the DARLING study. Am J Clin Nutr. 1991;53:457-465.
Bishara R, Dunn MS, Merko SE, Darling P. Nutrient composition of hindmilk produced by mothers of very low birth weight infants born at less than 28 weeks’ gestation. J Hum Lact. 2008;24:159-167.
Wojcik KY, Rechtman DJ, Lee ML, Montoya A, Medo ET. Macronutrient analysis of a nationwide sample of donor breast milk. J Am Diet Assoc. 2009;109:137-140.
Valentine CJ, Morrow G, Fernandez S, et al. Docosahexaenoic acid and amino acid contents in pasteurized donor milk are low for preterm infants. J Pediatr. 2010;157:906-910.
Te Braake FW, van den Aker CH, Wattimena DJ, Hujmans JG, van Goudoever JB. Amino acid administration to premature infants directly after birth. J Pediatr. 2005;147:457-461.
Denne SC, Poindexter BB. Evidence supporting early nutritional support with parenteral amino acid infusion. Semin Perinatol. 2007;31:56-60.
Flidel-Rimon O, Friedman S, Lev E, Juster-Reicher A, Amitay M, Shinwell ES. Early enteral feeding and nosocomial sepsis in very low birthweight infants. Arch Dis Child Fetal Neonatal Ed. 2004;89:F289-F292.
Henderson G, Craig S, Brocklehurst P, McGuire W. Enteral feeding regimes and necrotising enterocolitis in preterm infants: a multicentre case-control study. Arch Dis Child Fetal Neonatal Ed. 2009;94:F120-F123.
Patole SK, de Klerk N. Impact of standardised feeding regimens on incidence of neonatal necrotising enterocolitis: a systematic review and meta- analysis of observational studies. Arch Dis Child Fetal Neonatal Ed. 2005;90:F147-F151.
McCallie KR, Lee HC, Mayer O, Cohen RS, Hintz SR, Rhine WD. Improved outcomes with a standardized feeding protocol for very low birth weight infants. J Perinatol. 2011;31:S61-S67.
Arslanoglu S, Moro GE, Ziegler EE. Preterm infants fed fortified human milk receive less protein than they need. J Perinatol. 2009;29:489-492.
Corvaglia L, Aceti A, Paoletti V, et al. Standard fortification of preterm human milk fails to meet recommended protein intake: bedside evaluation by near-infrared-reflectance-analysis. Early Hum Dev. 2010;86:237-240.
Lucas A, Fewtrell MS, Morley R, et al. Randomized outcome trial of human milk fortification and developmental outcome in preterm infants. Am J Clin Nutr. 1996;64:142-151.
Mead Johnson Nutrition. Enfamil human milk fortifier acidified liquid, nutrients. http://www.mjn.com/app/iwp/hcp2/content2.do?dm =mj&id=HCP_Home2/ProductInformation/hcpProducts/hcpInfants/ hcpHMF&iiwpst=MJN&ils=0&icsred=1&ir=3482778687. Accessed May 2011.
Sullivan S, Schanler RJ, Kim JH, et al. An exclusively human milkbased diet is associated with a lower rate of necrotizing enterocolitis than a diet of human milk and bovine milk-based products. J Pediatr. 2010;156:562-567.
Prolacta Bioscience. http://prolacta.com/fortifier.php. Accessed April 2011.
Arslanoglu S, Moro GE, Ziegler EE. Adjustable fortification of human milk fed to preterm infants: does it make a difference? J Perinatol. 2006;26:614-621.
Hytten FE. Clinical and chemical studies in human lactation. Br Med J. 1954;1(4855):175-182.
Hall B. Uniformity of human milk. Am J Clin Nutr. 1979;32:304-312.
Picciano MF. Human milk: nutritional aspects of a dynamic food. Biol Neonate. 1998;74:84-93.
Griffin IJ, Cooke RJ. Nutrition of preterm infants after hospital discharge. J Pediatr Gastroenterol Nutr. 2007;45:S195-S203.
Zachariassen G, Faerk J, Grytter C, et al. Nutrient enrichment of mother’s milk and growth of very preterm infants after hospital discharge. Pediatrics. 2011;127:e995-e1003.
Aimone A, Rovet J, Ward W, et al. Growth and body composition of human milk-fed premature infants provided with extra energy and nutrients early after hospital discharge: 1-year follow-up. J Pediatr Gastroenterol Nutr. 2009;49:456-466.
Euser AM, Finken MJJ, Keijzer-Veen MG, et al. Associations between prenatal and infancy weight gain and BMI, fat mass, and fat distribution in young adulthood: a prospective cohort study in males and females born very preterm. Am J Clin Nutr. 2005;81:480-487.
Thureen PJ. The neonatologist’s dilemma: catch-up growth or beneficial undernutrition in very low birth weight infants. What are optimal growth rates? J Pediatr Gastroenterol Nutr. 2007;45:S152-S154.
Rotteveel J, van Weissenbruch MM, Twisk JWR, Delemarre-Van de Waal HA. Infant and childhood growth patterns, insulin sensitivity, and blood pressure in prematurely born young adults. Pediatrics. 2008;122:313-321.
Koo WW, Sherman R, Succop P, et al. Fractures and rickets in very low birth weight infants: conservative management and outcome. J Pediatr Orthop. 1989;9:326-330.
Mitchell SM, Rogers SP, Hicks PD, Hawthorne KM, Parker BR, Abrams SA. High frequencies of elevated alkaline phosphatase activity and rickets exist in extremely low birth weight infants despite current nutritional support. BMC Pediatr. 2009;9:47.
Sharp M. Bone disease of prematurity. Early Hum Dev. 2007;83:653-658.
Koletzko B, Baker S, Cleghorn G, et al. Global standard for the composition of infant formula: recommendations of an ESPGHAN coordinated international expert group. J Pediatr Gastroenterol Nutr. 2005;41:584-599.
Committee on Nutrition, American Academy of Pediatrics. Nutritional needs of the preterm infant. In: Kleinman RE, ed. Pediatric Nutrition Handbook. 6th ed. Elk Grove Village, IL: American Academy of Pediatrics; 2009:chap 4.
Jarjou LMA, Prentice A, Sawo Y, et al. Randomized, placebo-controlled, calcium supplementation study in pregnant Gambian women: effects on breast- milk calcium concentrations and infant birth weight, growth, and bone mineral accretion in the first year of life. Am J Clin Nutr. 2006;83:657-666.
Land C, Schoenau E. Fetal and postnatal bone development: reviewing the role of mechanical stimuli and nutrition. Best Pract Res Clin Endocrinol Metab. 2008;22:107-118.
Rigo J, Santerre J. Nutritional needs of premature infants: current issues. J Pediatr. 2006;149:S80-S88.
Demarini S. Calcium and phosphorus nutrition in preterm infants. Acta Pediatr. 2005;94(suppl 449):87-92.
Lewiecki EM. Benefits and limitations of bone mineral density and bone turnover markers to monitor patients treated for osteoporosis. Curr Osteoporos Rep. 2010;8:15-22.
Lucas A, Brooke OG, Baker BA, Bishop N, Morley R. High alkaline phosphatase activity and growth in preterm neonates. Arch Dis Child. 1989;64:902-909.
Huh SY, Feldman HA, Cox JE, Gordon CM. Prevalence of transient hyperphosphatasemia among healthy infants and toddlers. Pediatrics. 2009;124:703-709.
Faerk J, Peitersen B, Petersen S, Michaelsen KF. Bone mineralization in premature infants cannot be predicted from serum alkaline phosphatase or serum phosphate. Arch Dis Child Fetal Neonatal Ed. 2002;87:F133-F136.
Faerk J, Petersen S, Peitersen B, Michaelsen KF. Diet and bone mineral content at term in premature infants. Pediatr Res. 2000;47:148-156.
Fewtrell MS, Williams JE, Singhal A, Murgatroyd PR, Fuller N, Lucas A. Early diet and peak bone mass: 20 year follow-up of a randomized trial of early diet in infants born preterm. Bone. 2009;45:142-149.